Вопрос о том, что является правильным питанием и какое влияние те или иные диетические вмешательства оказывают на организм, очень обсуждаем в наши дни.
Однако большая часть научных исследований в этом направлении посвящена изучению эффекта отдельных питательных веществ в строго контролируемых условиях.
При этом остается открытым вопрос, какие изменения происходят в организме человека, который начинает придерживаться здорового питания, не меняя привычный ритм своей жизни.
Для ответа на этот вопрос группой ученых из лаборатории теоретической и прикладной функциональной геномики НГУ, научно-исследовательской компании «Атлас» и Университета ИТМО было проведено исследование, в рамках которого 248 добровольцев в течение двух недель придерживались рекомендаций диетолога, направленных на увеличение в пище количества полезных растительных волокон и уменьшение «пустых» калорий.
Ученых интересовало влияние диеты на организм в аспекте изменения состава бактериального сообщества (микробиоты) кишечника волонтеров. Для этого у каждого волонтера было собрано по два образца микробиоты — до и после следования рекомендациям. Эти образцы были проанализированы с помощью метагеномного ДНК-секвенирования. Результаты исследования опубликованы в научном журнале Nutrients.
Кишечные бактерии в большинстве своем являются симбионтами человека: защищают нас от инфекций, вырабатывают витамины и необходимую клеткам кишечника масляную кислоту, разлагают сложные полисахариды и участвуют в формировании иммунитета. При нарушении баланса микробиоты и организма человека повышается число бактерий-оппортунистов, вызывающих воспалительные процессы в кишечнике и другие проблемы со здоровьем.
В сообществе каждый микроб выполняет определенные функции, являясь звеном сложной метаболической сети, и состав поступающих извне с едой питательных веществ во многом определяет, какие микробы получат конкурентное преимущество.
С другой стороны, зачастую состояние здоровья также отражается на составе сообщества: по микробиоте человека можно с относительно высокой точностью предсказать наличие таких заболеваний, как диабет 2-го типа, ишемическая болезнь сердца и воспалительные заболевания кишечника.
Состав микробиоты достаточно сильно варьирует у людей и позволяет судить как об их диетических предпочтениях, так и о состоянии здоровья.
Представленность бактерий-бродильщиков, превращающих сложные полисахариды в полезные для человека короткоцепочечные жирные кислоты, — один из важных признаков здоровой микробиоты.
В исследовании было показано, что при следовании рекомендациям произошло значимое повышение представленности именно этих бактерий.
Это говорит о том, что, если человек изменит свое питание в сторону здорового даже в течение всего двух недель, будет оказано благоприятное влияние на микробиоту.
Однако на фоне возрастания представленности микробов, ассоциированных со здоровым состоянием организма, наблюдалась также некоторая дестабилизация кишечного сообщества: она в первую очередь выражалась в небольшом снижении его разнообразия.
Чем более разнообразно сообщество, тем более оно устойчиво к внешним воздействиям, таким как стресс или прием антибиотиков. Эффект снижения разнообразия, который наблюдался в исследовании, был достаточно небольшим.
По-видимому, он связан с тем, что микробиота не успела «оправиться» от достаточно быстрого изменения диеты.
— Материалы исследования легли в основу теста микробиоты, а вывод исследования очень практичный: можно улучшить состояние кишечника, увеличив количество пищевых волокон.
И это работает не только в строгих клинических исследованиях, но и в домашних условиях, — отметил Дмитрий Алексеев, старший научный сотрудник лаборатории теоретической и прикладной функциональной геномики НГУ.
Еще одно интересное наблюдение состояло в том, что у разных людей микробиота с разной силой отреагировала на диету: у некоторых людей состав сообщества изменился сильнее.
Группы не различались ни по характеру питания до исследования, ни по рекомендациям диетолога, однако с достаточно высокой точностью могли быть предсказаны по составу микробиоты до диеты.
Это наблюдение говорит о том, для повышения эффективности диетических рекомендаций важно учитывать не только текущее питание человека, но и состав его кишечного сообщества.
Значение кишечной микробиоты при иммунотерапии злокачественных новообразований. Взгляд онколога, иммунолога, гастроэнтеролога и микробиолога
Новости онкологии
27.08.2018
Семиглазова Т.Ю.1,2, Бриш Н.А.1, Галунова Т.Ю.1, Бернацкий А.С.1, Семиглазов В.В.1,3, Балдуева И.А.1,2, Проценко С.А.1
1 ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России; 2 ФГБОУ ВО «СЗГМУ им. И.И. Мечникова» Минздрава России; 3 ФГБОУ ВО «Первый СПбГМУ им. акад. И.П. Павлова» Минздрава России, Санкт-Петербург
Современная концепция симбиотических взаимоотношений между макроорганизмом и микробиотой кишечника не вызывает сомнений. На состав микробиоты прежде всего влияют факторы окружающей среды, генетические и иммунные факторы организма хозяина.
Дисбиоз кишечника может привести к доминированию некоторых видов бактерий, способствующих активации механизмов канцерогенеза и развитию злокачественных опухолей толстой кишки за счет хронического воспаления или местной иммуносупрессии.
В эру иммуноонкологии роль кишечной микробиоты в формировании ответа на иммунотерапию злокачественных новообразований представляет большой интерес для медицинского сообщества.
Учитывая, что состав кишечной микробиоты является индивидуальным для каждого человека, ее исследование как нельзя лучше вписывается в набирающую силу концепцию персонализированного медицинского подхода.
Ключевые слова: кишечная микробиота, иммунотерапия, checkpoint-ингибиторы, антибиотикотерапия.
ВВЕДЕНИЕ
Роль кишечной микробиоты в различных аспектах лечения онкологических заболеваний с каждым годом становится все более значимой темой для медицинского сообщества.
Это имеет свое отражение в количестве научных публикаций: при поиске работ, содержащих указание на связь состава микробиома с онкологическими заболеваниями, представлено более 1500 статей.
Разрабатываются новые методы использования микроорганизмов в диагностике, лечении и прогнозировании отдельных злокачественных новообразований.
Изучением роли количественного и качественного состава микрофлоры в формировании ответа на различные терапевтические агенты в настоящее время занимаются исследователи во многих странах мира. Большой интерес представляют научные работы, посвященные области иммунотерапии онкологических заболеваний. Также определение состава кишечной микробиоты является одной из перспективных задач, которая в будущем позволит оценивать клинический ответ на применение таргетных препаратов.
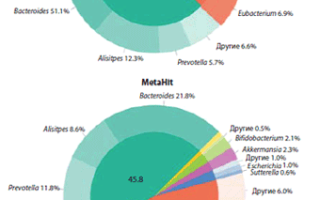
Микробиом желудочно-кишечного тракта в представлении современной науки рассматривается как гетерогенный набор разнообразных микроорганизмов, количественно и качественно отличающийся у каждого индивида и играющий значительную роль в биохимическом, метаболическом и иммунном гомеостазе макроорганизма, а также представляющий собой неспецифический барьер от экзогенных факторов агрессии. Условия среды в толстой кишке способствуют нормальной жизнедеятельности микроорганизмов, и численность 36000 видов бактерий достигает пиковых значений – 1010-1013 КОЕ/мл (1011 бактерий на грамм кишечного содержимого) именно в этом отделе кишечника [1-3]. Анаэробные бактерии преобладают над аэробами в соотношении 1000:1 [1-3]. На основании данных научных исследований общей популяции в Америке (клиническое исследование HMP) и в Европе (клиническое исследование MetaHIT) было показано, что доминантными типами микроорганизмов в составе микробиоты являются Bacteroidetes и Firmicutes [4-6].
Колонизация желудочно-кишечного тракта микроорганизмами начинается сразу же после рождения, а точнее уже при прохождении плода через родовые пути матери [7-9]. На разнообразие микробиома оказывает влияние большое количество факторов, таких как диета, половая и этническая принадлежность [10-14].
Способ родоразрешения при этом оказывается очень важным фактором, который обусловливает получение новорожденным первичной микробиоты. В нескольких зарубежных исследованиях доказана корреляция между кесаревым сечением и становлением иммунной системы [15-18].
Это означает, что состав комменсальной микрофлоры может играть роль в иммунном ответе и, таким образом, возможно, определяет уровень восприимчивости организма к различным заболеваниям [8, 19]. Дисбиоз кишечника, как проявление нарушения равновесия в бактериальной экосистеме, приводит к превалированию количества некоторых видов бактерий над другими.
Это может с большой степенью вероятности способствовать активации механизмов канцерогенеза и, как следствие, возникновению злокачественных новообразований [20-24].
Следует учитывать, что кишечный микробиом – модифицируемая единица, что может быть залогом хороших результатов восстановления благоприятного микробиоценоза у онкологических больных.
С началом развития методов иммунотерапии в последние годы стала рассматриваться также тема роли кишечной микробиоты в формировании ответа на воздействие различных классов противоопухолевых препаратов.
Результаты достаточно большого количества исследований показывают, что при внесении бактериальных образцов от доноров в организм пациентов, страдающих от онкологических заболеваний, стимулируется рост собственной микробиоты у реципиентов, увеличение ее разнообразности, что в свою очередь повышает способность организма осуществлять контроль над механизмами канцерогенеза [25-31]. Это дает основание дальнейшему исследованию корреляции между использованием иммунотерапевтических методов лечения злокачественных новообразований и значением состава микрофлоры кишечника. Некоторые исследователи говорят о том, что микробиота кишечника оказывает влияние на распространенность опухоли и, следовательно, продолжительность жизни пациентов путем воздействия на процессы молекулярного окислительного стресса [32-33] и системную генотоксичность периферических лейкоцитов [31], что приводит к снижению активности процессов системного воспаления, играющего основную роль в развитии злокачественных новообразований.
Учитывая, что состав кишечной микробиоты индивидуален для каждого отдельного человека, можно говорить о том, что необходимость его изучения соответствует принципам персонализированной медицины.
КИШЕЧНАЯ МИКРОБИОТА КАК МОДУЛЯТОР ОТВЕТАНА ИММУНОТЕРАПИЮ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ
Большинство работ, посвященных определению ключевой роли микробиома кишечника, были выполнены на мышиных моделях.
В подавляющем большинстве исследований было показано, что ответ опухоли на терапию химиопрепаратами и check-point ингибиторами (ингибиторами иммунных «точек контроля») [25, 34-38] был обусловлен накоплением опухолеспецифических Т-клеток CD8+ [37, 39-41].
Также в некоторых исследованиях было освещено участие дендритных клеток в активации данных механизмов, при этом установлено увеличение накопления и прайминга CD8+ Т-лимфоцитов в микроокружении опухоли [37, 42].
Мнение о том, бактерии каких преимущественно типов могут опосредовать наилучший ответ на противоопухолевую иммунотерапию, до сих пор не стало единым.
Имеются данные о том, что наиболее выраженную эффективность показывают анти-PD-1-препараты, применяющиеся для пациентов, у которых обнаруживается преобладание бактерий рода Ruminococcaceae в фекальных образцах [43].
Однако исследователи других крупных лабораторий сообщают о том, что относительное превалирование Clostridiales [38] связано с более высокой эффективностью проводимой терапии, а также есть сведения, говорящие, что у когорт пациентов с преобладанием Faecalibacterium значительно повышает показатель выживаемости без прогрессирования (PFS) [44]. При этом пациенты, в образцах которых отмечалось повышенное содержание Bacteroidales, имели меньшую PFS по сравнению с группой пациентов со сниженным количеством этих бактерий в образцах.
В противоположность вышеупомянутым результатам имеется мнение, что эффективность анти-CTLA-4-терапии взаимосвязано с наличием в составе кишечной нормобиоты различных представителей рода Bacteroidales. На базе мышиных моделей, для того чтобы убедиться в связи доминирования Bacteroidales spp.
с противоопухолевым эффектом анти-CTLA-4-препаратов, были выполнены повторные колонизации желудочно-кишечного тракта фекальными образцами, полученными от доноров и содержащими изоляты представителей рода Bacteroidales. На основании полученных данных было установлено, что заселение кишечника сочетанием B.
fragilis и Burkholderia cepacia было связано с более выраженной эффективностью анти-CTLA-4-препаратов, в отличие от всех других использованных изолятов [38].
По мнению авторов, формирование ответа на иммунотерапию могло быть обусловлено Akkermansia muciniphila, так как эти бактерии являются комменсалами, и их присутствие в фекальных образцах было чаще связано с наилучшим клиническим исходом заболевания [38].
В нескольких научных исследованиях было установлено, что повышение количества бактерий рода Bifidobacterium в составе кишечного микробиома формирует Т-клеточный противоопухолевый ответ [37, 39-40].
Также было показано, что обладание комменсальной флорой с превалированием рода Bifidobacterium может обусловливать повышение активности противоопухолевого иммунитета, что тем самым улучшает эффект анти-PD-L1-терапии [37].
И, конечно же, оценка взаимосвязи ответа на анти-CTLA-4-препараты с количественным и качественным составом микробиома кишечника в настоящее время также имеет большую ценность.
Анализ ряда зарубежных исследований показал, что имеются веские доказательства наличия изменений на уровне рода микроорганизмов сразу же после инициации лечения злокачественных новообразований с применением CTLA-4-ингибиторов.
Так, было зафиксировано быстрое уменьшение представительства как Bacteroidales, так и Burkholderiales, с относительным преобладанием содержания Clostridiales при использовании ипилимумаба [38, 46].
Из всего вышеизложенного можно сделать заключение, что CTLA-4-ингибиторы могут влиять на количественный состав рода Bacteroides spp. в кишечнике, обладающего иммуногенными свойствами, что, в свою очередь, влияет на эффективность препаратов данной группы.
Эффективность иммунотерапии онкологических заболеванийв условиях предшествующей антибиотикотерапии
Из проанализированных данных следует, что наиболее выраженный эффект иммунотерапии злокачественных опухолей возможно ожидать у пациентов, имеющих более широкое представительство микроогранизмов в составе микробиома кишечника.
Следовательно, встает вопрос о пользе изучения влияния антибиотиков, которое они оказывают на эффективность применения методов иммунотерапии онкологических заболеваний, например, checkpoint-ингибиторов.
Тот факт, что использование антибактериальных препаратов влечет за собой резкое изменение количественного и качественного состава микробиоты, как патогенной, так и комменсальной, на настоящее время доказан во множестве исследований [47-49].
Антибиотики, независимо от пути введения их в организм, изменяют гомеостатическое равновесие бактериальной флоры кишечника [50-51], что существенно влияет на метаболизм всей совокупности микроорганизмов.
В недавнем времени было установлено, что бактерии имеют значительное влияние на дифференцировку стволовых клеток. В свою очередь антимикробные препараты, изменяя состав микробиоценоза кишечника, приводят к различным модификациям путей развития клеток и, как следствие, к нарушениям физиологии на всех уровнях жизнедеятельности макроорганизма [52].
Кишечная микробиота играет важную роль в формировании иммунного ответа хозяина, поэтому необходимо учитывать то, что изменения ее состава могут приводить к негативным последствиям для макроорганизма [53].
Это было показано в ряде исследований, результаты которых говорят о том, что имеется определенная связь между составом микробиома и риском развития некоторых аутоиммунных заболеваний [53-55].
Согласно имеющимся данным нескольких доклинических исследований, микробиота влияет на активность ингибиторов иммунных контрольных точек, а применение антибактериальных препаратов широкого спектра действия приводит к снижению эффекта от их применения [56-57].
Существует мнение, что отрицательный эффект антибиотикотерапии на фоне использования checkpoint-ингибиторов связан исключительно с элиминацией комменсальной флоры.
На ежегодном международном урологическом симпозиуме (Орландо, Флорида), который был проведен в феврале 2017 года, были представлены результаты ретроспективного анализа данных 80 пациентов (Lisa Derosa et al.
, 2017) [56], установившие отчетливое снижение эффективности применения checkpoint-ингибиторов у больных почечно-клеточным раком, подвергшихся эмпирической или этиологической антибактериальной терапии за месяц до начала специального лечения.
Больным с диагнозом «метастатический почечно-клеточный рак» проводилась иммунотерапия ингибиторами иммунных «точек контроля»: монотерапия PD-1 или PD-L1 ингибиторами (n=67); комбинированная терапия PD-1 и CTLA-4 ингибиторами (n=10); комбинация PD-L1-ингибиторов и бевацизумаба (n=3).
Из 80 пациентов почечно-клеточным раком (65% из которых являлись мужчинами) за месяц до начала иммунотерапии 16 больных (20%) получали антибактериальную терапию в основном антибиотиками широкого спектра действия (бета-лактамные антибиотики и фторхинолоны).
Большинству больных ПКР (80%) была ранее выполнена нефрэктомия.
В исследовании показано, что более агрессивное течение почечно-клеточного рака после лечения ингибиторами точек иммунного контроля наблюдается у больных, подвергшихся антибактериальной терапии, в сравнении с пациентами, не получавшими антибактериальные препараты (медиана времени до прогрессирования составила 2,3 и 8,1 месяца соответственно, p
В россии провели «самое крупное исследование» по влиянию диеты на микробиоту кишечника
Кишечные бактерии в большинстве своем симбионты человека: защищают нас от инфекций, вырабатывают витамины и необходимую клеткам кишечника масляную кислоту, разлагают сложные полисахариды и участвуют в формировании иммунитета. При нарушении баланса микробиоты и организма человека повышается число бактерий-оппортунистов, вызывающих воспалительные процессы в кишечнике и другие проблемы со здоровьем.
В сообществе каждый микроб выполняет определенные функции, представляя собой звено сложной метаболической сети, и состав поступающих извне с едой питательных веществ во многом определяет, какие микробы получат конкурентное преимущество.
С другой стороны, зачастую состояние здоровья также отражается на составе сообщества: по микробиоте человека можно с относительно высокой точностью предсказать наличие таких заболеваний, как диабет второго типа, ишемическая болезнь сердца и воспалительные заболевания кишечника.
Состав микробиоты достаточно сильно варьируется у людей и позволяет судить как об их диетических предпочтениях, так и о состоянии здоровья.
Представленность бактерий-бродильщиков, превращающих сложные полисахариды в полезные для человека короткоцепочечные жирные кислоты, — один из важных признаков здоровой микробиоты.
В исследовании было показано, что после того, как участники эксперимента начали следовать рекомендациям диетолога, у них в кишечнике этих бактерий стало значительно больше.
Это говорит о том, что даже две недели здорового питания благоприятно влияют на микробиоту его кишечника.
Однако на фоне возрастания представленности микробов, ассоциированных со здоровым состоянием организма, наблюдалась также некоторая дестабилизация кишечного сообщества. В первую очередь это выражалось в том, что снижалось разнообразие микроорганизмов в кишечнике.
Чем более разнообразно сообщество, тем более оно устойчиво к внешним воздействиям, таким как стресс или прием антибиотиков. Эффект снижения разнообразия, который наблюдался в исследовании, был достаточно небольшим.
По-видимому, он связан с тем, что микробиота не успела «оправиться» от достаточно быстрого изменения диеты.
«Материалы исследования легли в основу теста микробиоты, а вывод исследования очень практичный: можно улучшить состояние кишечника, увеличив количество пищевых волокон. И это работает не только в строгих клинических исследованиях, но и в домашних условиях», — отметил Дмитрий Алексеев, старший научный сотрудник лаборатории теоретической и прикладной функциональной геномики НГУ.
Еще одно интересное наблюдение состояло в том, что у разных людей микробиота с разной силой отреагировала на диету: у некоторых людей состав сообщества изменился сильнее.
Группы не различались ни по характеру питания до исследования, ни по рекомендациям диетолога, однако с достаточно высокой точностью могли быть предсказаны по составу микробиоты до диеты.
Это наблюдение говорит о том, для повышения эффективности диетических рекомендаций важно учитывать не только текущее питание человека, но и состав его кишечного сообщества.
Понравился материал? Добавьте Indicator.Ru в «Мои источники» Яндекс.Новостей и читайте нас чаще.
Пресс-релизы о научных исследованиях, информацию о последних вышедших научных статьях и анонсы конференций, а также данные о выигранных грантах и премиях присылайте на адрес science@indicator.ru.
Сетевое издание Современные проблемы науки и образования ISSN 2070-7428 "Перечень" ВАК ИФ РИНЦ = 0,940
1
Курмангулов А.А. 1
Вахромеева К.А. 1
Дороднева Е.Ф. 1
1 ГБОУ ВПО «Тюменский государственный медицинский университет» Министерства здравоохранения РФ
Проведено открытое проспективное исследование влияния пищевых волокон в рамках компонентов диетического питания на функциональные характеристики микробиоты кишечника при метаболическом синдроме.
Исследовались биохимические (копрологические) и хроматографические (короткоцепочные жирные кислоты в кале) показатели собственного и симбиотного пищеварения. Шестимесячное наблюдение за пациентами показало предпочтение выбора пищевого рациона с включением не менее 35 г/сутки пищевых волокон по сравнению с классической диетической моделью, основанных на принципах рационального питания.
Статистически значимо улучшились антропометрические данные (масса тела, окружность талии), копрологические (pH кала, уровень йодофильных микроорганизмов) и хроматографических (общее содержание и спектр жирных кислот низкой молекулярной массы) в группе пациентов с метаболическим синдромом на фоне употребления, ежедневного употребления не менее 35 г/сутки пищевых волокон в составе рациона питания.
короткоцепочечные жирные кислоты
1. Белобородова Н. В. Интеграция метаболизма человека и его микробиома при критических состояниях // Общая реаниматология. – 2012. – Т. VIII, № 4. – С. 42–54.
2. Борщев Ю. Ю., Ермоленко Е. И. Метаболический синдром и микроэкология кишечника // Трансляционная медицина. – 2014. – № 1. – С. 19-28.
3. Егшатян Л. В., Ткачева О. Н., Кафарская Л. И.
Изменения кишечной микрофлоры, ассоциированный с возрастом и образом жизни // Ожирение и метаболизм. – 2015. – № 12(2). – С. 3-9.
4. Курмангулов А. А., Дороднева Е. Ф., Исакова Д. Н. Особенности пищеварения в кишечнике у людей с метаболическим синдромом // Медицинская наука и образование Урала. – 2015. – № 1. – С. 119-123.
5. Рекомендации Европейского Общества Кардиологов (пересмотр 2012 г.
) // Российский кардиологический журнал. – 2012. – № 4(96), приложение 2. – С. 1-84.
6. Ситкин С. И. Метаболом сыворотки крови и микробиота кишечника при язвенном колите и целиакии // Вестник Северо-Западного государственного медицинского университета им. И. И. Мечникова. – 2014. – Т. 6, № 3. – С. 12-22. 7. Сметанина С. А., Суплотова Л. А.
Табакокурение как модифицируемый фактор риска развития метаболических нарушений у женщин репродуктивного возраста при ожирении // Терапевт. – 2014. – № 10. – С. 10–14.
8. Суплотова Л. А., Сметанина С. А., Мурычева К. А.
Клинико-метаболические и молекулярно-генетические ассоциации у женщин репродуктивного возраста при инсулинорезистентности, ожирении и метаболическом синдроме // Медицинская наука и образование Урала. – 2013. – № 2 (74). – С. 84–87.
9. Siezen R. J., Kleerebezem M. The human gut microbiome: are we our enterotypes? // Microbial Biotechnology. – 2011. – № 4(5). – P. 550–3.
Актуальность.
Развитие метаболического синдрома определяется внутренними и внешнесредовыми факторами, к числу которых, наряду с генетической предрасположенностью, возрастом, пищевым поведением, гиподинамией, курением [7,8], исследователи все чаще стали относить изменение функциональной активности микробиоты кишечника [2, 6].
Однако существующие методы исследования микроорганизмов кишечника посредством бактериального посева на питательные среды показали свою низкую диагностическую ценность [9].
Новая генерация некультуральных методов исследования, основанная на изучении стойких метаболитов микроорганизмов в кале, среди которых короткоцепочные жирные кислоты (КЖК) занимают особую роль, дает новые возможности количественной и качественной оценки микробиоты кишечника [3, 4].
Низкомолекулярные метаболиты микроорганизмов могут являться эффекторами, кофакторами и сигнальными молекулами, регулирующими скорость и выраженность протекания метаболических реакций как в норме, так и при патологических процессах. Результаты исследований последних лет свидетельствуют о том, что изучение микробиоты кишечника при МС дает возможность для оценки дополнительных факторов этиологии, патогенеза данной патологии, а также разработки на этой основе современных программ диагностики и лечения МС. Появление продуктов питания с пищевыми волокнами (ПВ), являющимися пребиотиками для микроорганизмов [1], открывает новые возможности воздействия на микробиоту кишечника, что и определяет актуальность настоящего исследования.
Целью открытого контролируемого исследования было изучение немедикаментозного влияния на функциональную активность микробиоты кишечника у людей с МС.
Материал и методы исследования.
Критерием включения в исследование явилось наличие диагноза МС, верифицированного на основании установления минимум трех из 5 нижеперечисленных критериев: центральный (абдоминальный) тип ожирения – окружность талии (ОТ) более 80 см у женщин и более 94 см у мужчин, повышенное артериальное давление (АД) ?≥ ?130/85 мм рт.
ст.; повышение уровня триглицеридов ?≥? 1,7 ммоль/л; снижение уровня липопротеины высокой плотности (у мужчин < 1,0 ммоль/л, у женщин < 1,3 ммоль/л); гипергликемия натощак (глюкоза в плазме крови натощак ?≥ ?6,1 ммоль/л).
Критериями исключения из исследования явились: возраст старше 50 лет; острые воспалительные заболевания или обострение хронических заболеваний, симптоматические варианты артериальной гипертонии, заболевания соединительной ткани, онкологическая патология, острые кишечные инфекции и/или острые заболевания неизвестной этиологии с кишечной симптоматикой, перенесенные менее 3 месяцев назад, другие соматические заболевания в стадии декомпенсации, с неблагоприятным ближайшим прогнозом, эпизоды гипертермии за 3 месяца до исследования, неустановленной этиологии, лечение антимикробными препаратами в период за 3 месяца до исследования, отказ от участия в исследовании, предполагаемые затруднения последующего проспективного наблюдения.
В исследовании приняли 51 человек с МС, которые в соответствии с задачами работы была разделены на три группы. В 1-ой группе (n=18) проводилась коррекция веса путем диетической модели, основанной на классических принципах рационального питания.
В качестве базы для модели брались Европейские клинические рекомендации по профилактике ССЗ (пересмотр 2012 г.) [5]. Во 2-ой группе (n=17) к указанной выше методике добавлялись компоненты функционального питания, которые по технологии создания можно было разделить на две группы продуктов.
Первая группа была представлена продуктами, содержащими в нативном виде значительные количества ПВ. К ним относились хлебобулочные изделия из муки грубого помола, крупы определенных сортов злаков (гречневая), некоторые виды овощей (горох, фасоль, капуста брюссельская, лук-порей, спаржа и др.) и фруктов (груша, слива, курага и др.
), морские гидробионты. Вторая группа представляла собой продукты, дополнительно технологическим способом обогащенные ПВ (отруби, хлопья различных видов злаков).
Продукты второй группы не относились ни к лекарственным препаратам, ни к биологически активным добавкам, были полностью безопасны и предназначены для употребления в качестве продуктов питания.
Диетическая программа составлялись каждому пациенту отдельно на основании полученных первичных данных оценки потребления групп ПВ, при этом суточное содержание в рационе ПВ у каждого пациента доводилось до 35 г. Важным пунктом было соблюдении адекватного водного баланса с употреблением не менее 2 литров жидкости ежедневно. 3-ью группу (группа контроля) (n=16) составили исследуемые, по тем или иным причинам не прошедшие немедикаментозную коррекцию веса.
Исследуемые образцы фекалий подвергались макро- и микроскопическому, а также химическому исследованиям.
Хроматографическое исследование КЖК в кале проводилось на газожидкостном хроматографе с изотермическим режимом работы (температура термостата 150 0С, температура испарителя и детектора 230 0С, газ-носитель – азот, с давлением на входе в колонку 1,8 атм.
, расход газа-носителя – 2мл/мин, воздуха 300 мл/мин, соотношение потоков газа-носителя на сброс и в колонку – 50:1). Время хроматографирования одной пробы составляло около 8 мин.
Протеолитическую активность микроорганизмов оценивали по сумме концентраций изокислот С4-С6 — ИзоСn ∑(изоС4+изоС5+ изоС6), а также пропорции всех изокислот С4-С6 ко всем неразветвленным кислотам С4-С6 (ИзоСn/Сn).
Для количественной оценки изменения окислительно-восстановительного баланса в полости кишечника рассчитывался анаэробный индекс (АИ) – отношение суммы концентраций (С) восстановленных кислот к менее восстановленным: Спропионовая+ Смасляная/Суксусная.
Для изучения особенностей фактического питания использовался метод анализа общей полуколичественной оценки потребления групп пищевых продуктов, пищевых веществ и энергии с учетом особенностей питания населения России.
В основе данного метода лежит метод ретроспективной регистрации количества, частоты и вида потребляемого продукта питания в течение предшествующего месяца, осуществляемое посредством заполнения формы-вопросника, включающего 67 видов продуктов и блюд с последующей обработкой результатов.
Данный алгоритм позволил классифицировать обследуемых по характеру питания и величинам потребления основных групп пищевых продуктов, в том числе и ПВ.
Все группы исследования были сопоставимы по основным медико-биологическим характеристикам и при проведении сравнительного анализа с применением критерия Манна – Уитни уровень р не принимал значений меньше 0,05. Период наблюдения составил 6 месяцев, по истечению которого проводилось повторное клинико-лабораторное обследование, включая развернутое копрологическое и хроматографическое исследование кала.
Результаты исследования. Анализ антропометрических и некоторых клинических данных полученных результатов с помощью критерия Вилкоксона показал статистически значимое динамическое снижение веса, индекса массы тела (ИМТ), ОТ, индекс окружность талии/окружность бедер (ОТ/ОБ) в 1-ой и 2-ой группах исследования (p
Роль микробиоты кишечника в поддержании здоровья
Микрофлора представляет собой метаболически активную и сложную экосистему, состоящую из сотен тысяч микроорганизмов — бактерий, вирусов и некоторых эукариот. Подобно невидимому чулку, биоплёнка покрывает все слизистые нашего организма и кожу. Микробиота объединяет более чем 1014 (сто биллионов) клеток микроорганизмов, что в 10 раз превышает число клеток самого организма.
Микробиота находится в содружественных отношениях с организмом человека: организм хозяина предоставляет среду обитания и питательные вещества, микроорганизмы защищают организм от патогенных возбудителей, способствуют поддержанию нормальных иммунологических, метаболических и моторных функций.
Выделяют несколько важных биотопов, которые отличаются плотностью распределения микроорганизмов и составом: кожные покровы, слизистые оболочки ЖКТ, дыхательных путей, урогенитального тракта и проч. Самой многочисленной считается микробиота кишечника, на её долю приходится 60% микроорганизмов, колонизирующих организм человека.
Микрофлора кишечника состоит из группы микроорганизмов, представленных более чем 1000 видами, 99% из которых приходится на 30–40 главных видов. В научных кругах кишечную микрофлору называют также дополнительным органом. Состояние микробиоты кишечника определяет качество и продолжительность жизни. У каждого человека есть свой индивидуальный характер распределения и состава микробиоты.
Частично он определяется генотипом хозяина и первоначальной колонизацией, которая происходит сразу после рождения. Различные факторы, такие как тип родов, кормление грудью, образ жизни, диетарные предпочтения, гигиенические условия и условия окружающей среды, использование антибиотиков и вакцинация, могут определять окончательные изменения в структуре микробиоты.
При изменении состава или функции микробиоты развивается дисбиоз. Дисбиотические состояния изменяют моторику кишечника и его проницаемость, а также искажают иммунный ответ, тем самым создавая предпосылки для развития провоспалительного состояния.
Такие изменения, особенно в отношении иммунных и метаболических функций хозяина, могут вызывать или способствовать возникновению ряда заболеваний, например, сахарного диабета, ожирения, неврологических и аутоиммунных заболеваний.
Недавние исследования показали, что микробиота участвует в этиопатогенезе многих гастроэнтерологических заболеваний, таких как синдром раздраженного кишечника, воспалительные заболевания кишечника, целиакия, неалкогольный стеатогепатит и новообразования желудочно-кишечного тракта.
- Кишечная микрофлора и иммунитет
- Кишечная микробиота и обмен веществ
- Микробиота и нервная система
Кишечная микробиота имеет решающее значение для развития лимфоидных тканей, а также для поддержания и регуляции кишечного иммунитета.
В кишечнике происходит сенсибилизация иммуноцитов, которые затем заселяют другие слизистые оболочки и циркулируют между различными органами. Этот механизм обеспечивает формирование клонов лимфоцитов и образование специфических антител в участках слизистой оболочки, отдалённых от очага первичной сенсибилизации. Иммунокомпетентные ткани пищеварительного тракта объединены в лимфоидную ткань.
Лимфоидная ткань представлена лимфоцитами, расположенными между эпителиальными клетками кишечника, лимфоцитами собственного слоя, пейеровыми бляшками (скопления лимфоидной ткани в тонкой кишке) и лимфоидными фолликулами.
Попавшие в просвет кишечника или на слизистые оболочки антигены распознаются иммуноглобулинами памяти (IgG), после чего информация передаётся в иммунокомпетентные клетки слизистой оболочки, где из сенсибилизированных лимфоцитов клонируются плазматические клетки, ответственные за синтез IgА и IgМ.
В результате защитной деятельности этих иммуноглобулинов включаются механизмы иммунореактивности или иммунотолерантности. Благодаря индукции иммунологической толерантности в кишечнике не возникают нежелательные воспалительные реакции против кишечной микробиоты и пищевых белков.
Кишечная микробиота вносит непосредственный вклад в метаболизм питательных веществ и витаминов, необходимых для жизнедеятельности организма хозяина, при этом извлекая энергию из пищи. Эта энергия образуется путём реакции сбраживания не усваиваемых углеводов (клетчатки), в результате реакции образуются короткоцепочечные жирные кислоты, водород и углекислый газ.
Короткоцепочные жирные кислоты обеспечивают работу колоноцитов. Короткоцепочные жирные кислоты считаются тонкими регуляторами иммунитета, энергетического обмена и метаболизма жировой ткани. Например, короткоцепочные жирные кислоты участвуют во взаимодействии бактерий и иммунитета, подавляя сигналы, которые могут привести к развитию аутоиммунных реакций.
Пропионовая и масляная жирная кислота положительно влияют на метаболизм глюкозы. Наконец, короткоцепочные жирные кислоты обеспечивают подкисление просвета толстой кишки, предотвращая рост бактериальных патогенов. Кишечная микробиота принимает непосредственное участие в метаболизме желчных кислот, источником которых является холестерин.
В печени из холестерина синтезируются первичные желчные кислоты — холевая и хенодезоксихолевая, которые поступают в кишечник. Бактероиды и лактобациллы далее превращают первичные желчные кислоты во вторичные желчные кислоты — дезоксихолевую и литохолевую. Изменение нормального баланса кишечных бактерий приводит к неадекватному синтезу желчных кислот.
Ещё более удивительные данные о взаимосвязи кишечной микробиоты и нервной системы. Микробиота кишечника тесно общается с центральной нервной системой. Микробиота кишечника производит такие нейроактивные молекулы, как ацетилхолин и серотонин, дофамин, которые являются главными медиаторами сигналов в ЦНС, а также регулируют работу мозга через активацию иммунных сигнальных путей.
Дополнительно, блуждающий нерв активно участвует в двунаправленных взаимодействиях между кишечной микробиотой и мозгом для поддержания гомеостаза как в головном мозге, так и в кишечнике. Недавние исследования показали, что микробиом влияет на свойства и функцию микроглии. Микроглия защищает мозг от различных патологических состояний через активацию иммунного ответа, фагоцитоза и продукцию цитокинов. Кроме того, микроглия ответственна за формирование нейронных цепей, которые участвуют в развитии мозга. Различные дисбиотические состояния, в том числе вызванные приёмом антибиотиков приводят к угнетению созревания клеток микроглии. Незрелая микроглия приводит к нарушению иммунной активации.
Астроциты — самая многочисленная клеточная популяция в ЦНС, и они почти в пять раз превосходят численность нейронов. Подобно микроглии, астроциты выполняют несколько важных функций по поддержанию целостности ЦНС, включая контроль кровообращения в головном мозге, поддержание стабильности гематоэнцефалического барьера. Астроциты регулируют баланса ионов и оказывают влияние на передачу сигналов между нейронами. Чрезмерная активация астроцитов является пусковым механизмом в развитии дисфункции ЦНС и неврологических расстройств. Чрезмерная активация происходит под действием метаболитов микрофлоры.
Целостность гематоэнцефалического барьера регулируется также метаболитами микробиоты, которые опосредуют передачу большего количества микробных сигналов между осью кишечник-мозг.
Дисбиоз микробных видов в кишечнике может вызывать атипичные иммунные сигналы, дисбаланс в гомеостазе организме-хозяина и привести к прогрессированию заболеваний ЦНС. Например, рассматривается роль микробиоты в патогенезе рассеянного склероза-заболевания, характеризующимся демиелинизацией аксонов нервных клеток.
При болезни Паркинсона, которая проявляется моторными симптомами, включая тремор, мышечную ригидность, медлительность движений и аномалию походки наблюдается накопление α-синуклеина в нейронах.
Избыточное отложение α-синуклеина в нервной системе инициируется кишечной микрофлорой до того, как возникают симптомы поражения ЦНС, что связано с некоторыми специфическими пищеварительными симптомами (запоры и нарушение двигательной функции толстой кишки).
Бактериальный состав кишечника влияет на болезнь Паркинсона: тяжесть симптомов, в том числе постуральная нестабильность и нарушение походки, связана с изменениями численности некоторых видов Enterobacteriaceae, уменьшение количества Lachnospiraceae приводит к более серьёзному ухудшению моторных и немоторных симптомов у пациентов с болезнью Паркинсона. Болезнь Альцгеймера — ещё одно нейродегенеративное заболевание, которое приводит к серьёзным нарушениям функции ЦНС — обучению, памяти и поведенческим реакциям. Болезнь Альцгеймера характеризуется отложением пептида амилоид-β (Aβ) снаружи и вокруг нейронов, вместе с накоплением белка тау внутри корковых нейронов. Перегрузка амилоидом и агрегация тау нарушают синаптическую передачу. Изменение состава и разнообразия микробиоты вносит определённый вклад в патогенез болезни Альцгеймера. Активированная микроглия способствует развитию заболевания, увеличивая отложение амилоида.
Ожирение и состав микробиоты
При ожирении и сахарном диабете наблюдаются изменения в составе микробиоты кишечника, в частности, снижение популяционного уровня сахаролитических бактероидов, влияющих на интенсивность метаболических процессов, а также увеличение доли бактерий класса Firmicutes (Esherichia coli, Clostridium coccoides, Clostridium leptum). Снижение содержания сахаролитических бактерий уменьшает выработку коротко-цепочных жирных кислот, обеспечивающих трофику и деление эпителия кишечника, его созревание, оказывающих антимикробное действие и регуляторное действие в отношении ионов и липидов.
Дополнительно при ожирении отмечается хроническое системное воспаление, сопровождающееся секрецией провоспалительных цитокинов (интерлейкины — ИЛ, С-реактивный белок, α-фактор некроза опухоли — α-ФНО и др.
) в висцеральной жировой ткани.
Нарушения в составе кишечной микрофлоры приводят к усилению эффекта системного воспаления за счёт увеличения концентрации бактериальных липополисахаридов, стимулирующих выработку провоспалительных компонентов.
Диагностика состояния кишечной микробиоты
Существует два метода определения микробиоты — стандартный анализ на дисбактериоз и оценка состава микробиоты методом масс-спектрометрии по крови (ГХ-МС). В основе методики масс-спектрометрии лежит определение присутствия микроорганизмов по их клеточным компонентам (высшие жирные кислоты, альдегиды, спирты и стерины). Методика разработана профессором Осиповым Г.А. Метод ГХ-МС позволяет одновременно измерять более сотни микробных маркёров непосредственно в образце, позволяющих сделать заключение о некультивируемых и труднокультивируемых патологических возбудителях. Метод универсален также в отношении грибов и вирусов.
Влияние патологических изменений микробиоценоза кишечника на появление или усиление негативного поведения детей с рас
ВЛИЯНИЕ ПАТОЛОГИЧЕСКИХ ИЗМЕНЕНИЙ МИКРОБИОЦЕНОЗА КИШЕЧНИКА
НА ПОЯВЛЕНИЕ ИЛИ УСИЛЕНИЕ НЕГАТИВНОГО ПОВЕДЕНИЯ ДЕТЕЙ С РАС
Научная статья
Максимова А. А.*
- Медицинский центр “Miraculum”, Тбилиси, Грузия
- * Корреспондирующий автор (aleksandra-krasn[at]mail.ru)
- Аннотация
Доказано, что многие проявления негативного поведения являются следствием преобладания патогенной микрофлоры в кишечнике детей с расстройствами аутичного спектра.
Устранение выявленных бактериальных и грибковых инфекций приводило к уменьшению или исчезновению негативного поведения, а в случае рецидивов – к их возвращению.
Негативное поведение было связано с дисбалансом нейромедиаторов, влиянием метаболитов патогенных бактерий в качестве нейротоксинов, возникновением висцеральных и абдоминальных болей на фоне прямого и опосредованного влияния на блуждающий нерв и симпатический ствол у детей с аутизмом. Родителям и клиническим врачам рекомендовано при негативном поведении детей обращать внимание на возможные проблемы с желудочно-кишечным трактом прежде, чем прибегать к психотропным препаратам.
- Ключевые слова: аутизм, бактериальная инфекция, микробиом, нарушения сна, негативное поведение.
- ABNORMALITIES OF GASTROINTESTINAL MICROBIOCENOSIS INFLUENCING AVERSIVE BEHAVIOUR OF ASD CHILDREN MANIFESTING OR INTENSIFYING
- Research article
Maximova A.A.*
- Miraculum Medical Centre, Tbilisi, Georgia
- * Corresponding author (aleksandra-krasn[at]mail.ru)
- Abstract
It is proved that many manifestations of aversive behaviour are the result of the predominance of intestinal pathogenic microflora of children having autism spectrum disorders. Eradicating the identified bacterial and fungal infections led to a decrease or disappearance of aversive behaviour, and in the case of relapses, it returned.
Aversive behaviour occurred due to the neurotransmitter imbalance, neurotoxic action of pathogenic bacteria metabolites, the occurrence of visceral and abdominal pain affected by direct and indirect effects on the vagus nerve and sympathetic trunk of autistic children.
Parents and clinicians are recommended to pay attention to the possible gastrointestinal problems when noticing aversive behaviour before resorting to psychotropic medication.
- Keywords: autism, bacterial disease, microbiome, sleep disorders, aversive behaviour.
- Цель исследования: доказать зависимость негативного поведения детей с расстройствами аутичного спектра от нарушений микробиоценоза кишечника.
- Задачи исследования:
- Установить высокую степень корреляции между (1) состоянием желудочно-кишечного тракта (далее – ЖКТ) и нарушениями микробиоценоза кишечника и (2) негативным поведением (тревожность, агрессия/самоагрессия, неконтролируемые истерики, истерический смех), нарушениями сна и эмоциональной лабильностью детей с расстройством аутичного спектра.
- Показать причинно-следственную связь между (1) стабилизацией работы ЖКТ и восстановлением микробиоценоза кишечника и (2) исчезновением / уменьшением негативного поведения, успешной коррекцией нарушений сна и эмоциональной лабильности у детей с расстройством аутичного спектра.
- Описать и рекомендовать для клинической практики варианты диагностики нарушений микробиоценоза кишечника, использованные в описываемом исследовании.
- Предложить потенциальные терапевтические стратегии и противовоспалительные протоколы питания для (1) борьбы с чрезмерным разрастанием конкретных патогенных бактериальных и грибковых инфекций и (2) коррекции нарушений микробиоценоза кишечника.
Материалы исследования