Ученые из Центра иммунологии и исследования нейроглии мозга (BIG) при университете Вирджинии (США), под руководством профессора Джонатана Кипниса (Jonathan Kipnis), обнаружили в оболочке мозга лимфатические сосуды, напрямую связывающие его со всей иммунной системой организма. Это удивительное открытие обещает произвести переворот в лечении тяжелых болезней, таких, как болезнь Альцгеймера. Подробную статью о данном исследовании, опубликованную в журнале Nature, пересказывает сайт NeuroScientistNews.
Это открытие стало возможным благодаря разработке Антуана Луво (Antoine Louveau), постдока из лаборатории Кипниса. Луво придумал, как отделить целиком оболочку мозга мыши, не нарушая ее хрупкую структуру, и сделать из нее препарат для изучения под микроскопом. Именно на таком препарате ученые и разглядели лимфатические сосуды, которых, как считалось до сих пор, в мозгу нет.
По словам Кипниса, разглядеть эти лимфатические сосуды непросто, поскольку они проходят бок о бок с кровеносными, и впадают в общие синусы (коллекторы сосудов) в мозговой оболочке. Неудивительно, что до сих пор они ускользали от внимания ученых. «Я думал, подобные открытия закончились где-то в середине прошлого века, — сказал Кипнис. — Но, оказалось, что нет».
Эта сенсационная находка, похоже, не только заставит переписать учебники, но и произведет переворот в лечении многих связанных с мозгом серьезных болезней.
Например, у многих больных рассеянным склерозом отмечаются также серьезные сбои в работе иммунной системы, и теперь ясно, что это не простое совпадение.
Далее, при болезни Альцгеймера в мозгу скапливаются комочки белка — возможно, именно потому, что эти сосуды их вовремя не выводят.
«Мы полагаем, что эти [лимфатические] сосуды играют ключевую роль в развитии любой нервной болезни, имеющей иммунный компонент. Сложно представить, как они могли бы в этом не участвовать», — резюмировал Кипнис.
Для того, чтобы выяснить конкретные механизмы взаимодействия мозга с иммунной системой, и разобраться, как сбои в этом взаимодействии приводят к болезням, потребуется много новых исследований.
Исследование такой сложнейшей системы, как наш мозг, регулярно преподносит сюрпризы. Так, недавно выяснилось, что даже от незрячих от рождения людей формируется вполне полноценная зрительная кора. Это открытие также может иметь важное прикладное значение, в разработке действующих протезов глаз.
Мощный толчок подобным исследованиям должна дать первая база данных о нейронах головного мозга, недавно составленная и выложенная в интернет.
Информация предоставлена Информационным агентством «Научная Россия». Свидетельство о регистрации СМИ: ИА № ФС77-62580, выдано Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций 31 июля 2015 года.
В вашем браузере отключен JavaScript. Будет показана упрощенная версия сайта, в которой могут отсутствовать многие функции.
Как работает иммунитет. Основные понятия
- Иммунитет: борьба с чужими и… своими
- (краткий обзорный материал)
- СОДЕРЖАНИЕ:
Иммунитет — система реакций, призванная защитить организм от вторжения бактерий, вирусов, грибов, простейших и других вредоносных агентов — так называемых патогенов. Если представить, что наше тело — это страна, то иммунную систему можно сравнить с ее вооруженными силами. Чем более слаженным и адекватным будет их ответ на интервенцию патогенов, тем надежнее окажется защита организма (см. также: адаптивный иммунитет, врожденный иммунитет, гуморальный иммунитет (выработка антител), клеточный иммунитет).
Для того чтобы бороться с разными патогенами, в результате длительной эволюции сформировалась замысловатая система из иммунных клеток, каждая из которых имеет свою стратегию борьбы. Клетки иммунной системы взаимно дополняют друг друга: применяют разные способы уничтожения патогена, могут усиливать или ослаблять действие других клеток, а также привлекать всё новых бойцов на поле битвы, если сами не справляются. Нападая на организм, патогены оставляют молекулярные «улики», которые «подбирают» иммунные клетки. Такие улики называются антигенами.
Антигены — любые вещества, которые организм воспринимает как чужеродные и, соответственно, отвечает на их появление активацией иммунитета. Самыми важными для иммунной системы антигенами являются кусочки молекул, расположенных на внешней поверхности патогена. По этим кусочкам можно определить, какой именно агрессор напал на организм, и обеспечить борьбу с ним.
Цитокины
«Азбука Морзе» организма
Для того чтобы иммунные клетки могли скоординировать свои действия в борьбе с врагом, им необходима система сигналов, сообщающих, кому и когда вступать в бой, или заканчивать битву, или, наоборот, возобновлять ее, и многое-многое другое.
Для этих целей клетками вырабатываются небольшие белковые молекулы — цитокины, например, различные интерлейкины (ИЛ-1, … или IL-1, 2, 3 и т.д.) [1].
Многим цитокинам сложно приписать однозначную функцию, однако с некоторой степенью условности их можно разделить на пять групп: хемокины, факторы роста, провоспалительные, противовоспалительные и иммунорегуляторные цитокины.
- Хемокины подают клетке сигнал, который говорит, куда ей нужно двигаться. Это может быть инфицированное место, куда необходимо стянуть все боевые подразделения нашей армии, или же определенный орган иммунной системы, где клетка будет дальше проходить обучение военной грамоте (о хемокинах см. здесь→).
- Факторы роста помогают клетке определиться, какую «воинскую специальность» для себя выбрать. По названиям этих молекул, как правило, легко понять, за развитие каких клеток они отвечают. Так, гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КС или англ. GM-CSF) способствует появлению гранулоцитов и макрофагов (о группе CSF см. здесь →), а фактор роста эндотелия сосудов (VEGF), как следует из названия, отвечает за образование новых сосудов кровеносной системы
- О провоспалительных, противовоспалительных и иммунорегуляторных цитокинах говорят, что они «модулируют» иммунный ответ. Именно эти молекулы клетки используют для «разговора» между собой, ведь любое совместное дело должно строго регулироваться, чтобы ключевые игроки не запутались в том, что им делать, и не мешали друг другу, а эффективно выполняли свои функции. Провоспалительные цитокины, как следует из названия, способствуют поддержанию воспаления, которое необходимо для эффективной иммунной реакции в борьбе с патогенами, тогда как противовоспалительные цитокины помогают организму остановить войну и привести поле боя в мирное состояние. Сигналы иммунорегуляторных цитокинов могут быть расшифрованы клетками по-разному в зависимости от того, что это за клетки и какие другие сигналы они к этому времени получат.
- Подробнее о цитокинах см. по кнопке-ссылке:
- Упомянутая выше условность классификации означает, что цитокин, входящий в одну из перечисленных групп, при определенных условиях в организме может сыграть диаметрально противоположную роль — например, из провоспалительного превратиться в противовоспалительный.
Без налаженной связи между видами войск любая хитроумная военная операция обречена на провал, поэтому клеткам иммунной системы очень важно, принимая и отдавая приказы в виде цитокинов, правильно их интерпретировать и слаженно действовать.
Если цитокиновые сигналы начинают вырабатываться в очень большом количестве, то в клеточных рядах наступает паника, что может привести к повреждению собственного организма.
Это называется цитокиновым штормом: в ответ на поступающие цитокиновые сигналы клетки иммунной системы начинают продуцировать всё больше и больше собственных цитокинов, которые, в свою очередь, действуют на клетки и усиливают секрецию самих себя. Формируется замкнутый круг, который приводит к разрушению окружающих клеток, а позже и соседних тканей.
Иммунные клетки
По порядку расчитайсь!
Все клетки, относящиеся к иммунной системе и привлекаемые ею для обеспечения эффекторных реакций, в функциональном отношении условно разделяют на четыре группы.
- Антигенпрезентирующие клетки (АПК или APC):макрофаги, дендритные клетки типов 1 и 2, В-лимфоциты.
- Регуляторные клетки (см. также Тreg):T-индукторы, Т-хелперы типов 1, 2 и 3, естественные регуляторные Т-клетки.
- Эффекторные клетки: плазматические клетки (дифференцирующиеся из В-лимфоцитов), цитотоксические Т-клетки с фенотипом CD8+ (или T-киллеры); эффекторные Т-клетки воспаления с фенотипом CD4+ (или Т-лимфоциты, ответственные за гиперчувствительность замедленного типа); нейтрофилы, эозинофилы, базофилы, тучные клетки, натуральные киллеры (NK-клетки), макрофаги.
- Клетки памяти: Т-клетки памяти с фенотипом CD8+; Т-клетки памяти с фенотипом CD4+; долгоживующие плазматические клетки; В-клетки памяти.
Как в вооруженных силах существуют разные рода войск, так и клетки иммунной системы можно разделить на две большие ветви — врожденного и приобретенного иммунитета, за изучение которых в 2011 году была вручена Нобелевская премия [2].
Врожденный иммунитет — та часть иммунной системы, что готова защищать организм немедленно, как только совершилось нападение патогена.
Приобретенный же (или адаптивный) иммунный ответ при первом контакте с врагом разворачивается дольше, так как требует хитроумной подготовки, но зато после может осуществлять более сложный сценарий защиты организма.
Врожденный иммунитет очень эффективен в борьбе с единичными диверсантами: он обезвреживает их не, беспокоя специализированные элитные воинские подразделения — адаптивный иммунитет. Если же угроза оказалась более существенной и есть риск проникновения патогена всё глубже в организм, клетки врожденного иммунитета немедленно сигнализируют об этом, и в бой вступают клетки иммунитета приобретенного.
Все иммунные клетки организма образуются в костном мозге от кроветворной стволовой клетки, которая дает начало двум клеткам — общему миелоидному и общему лимфоидному предшественникам [3].
Клетки приобретенного иммунитета происходят от общего лимфоидного предшественника и, соответственно, называются лимфоцитами, тогда как клетки врожденного иммунитета могут брать начало от обоих предшественников.
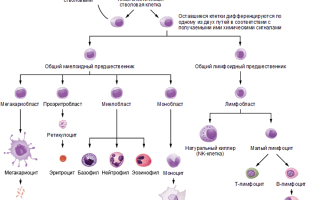
Схема дифференцировки клеток иммунной системы изображена на рисунке 1.
Рис. 1. Схема дифференцировки клеток иммунной системы.
Кроветворная стволовая клетка дает начало клеткам — предшественницам миелоидной и лимфоидной линий дифференцировки, из которых дальше образуются все типы клеток крови.
«Регулярная армия»
Иммунная система мозга
Наше здоровье защищает целая слаженная система — иммунитет. Без перерыва многочисленные иммунные клетки борются с чужеродными веществами и микроорганизмами, но … только не в мозге. Наш мозг и нервная система отделены от иммунитета всего остального тела. Но как же тогда мозг справляется без него?
Автономность мозга и ЦНС
Еще с конца 19в искали причину того, что мешает веществам проникать из общего кровотока в мозг. В опытах с красителем в венах замечали, что окрашивается все ткани организма, кроме мозга. То же самое происходило с красителем, введенным в спинномозговую жидкость: мозговые ткани окрашивались, в то время как другие органы — нет.
А в 1921г впервые было выдвинуто название предполагаемого барьера.
«Между кровью, с одной стороны, и спинномозговой жидкостью, с другой, есть особый аппарат или механизм, способный просеивать вещества, обыкновенно присутствующие в крови или случайно проникшие в неё…Мы предлагаем называть гематоэнцефалическим барьером»
Лина Штерн, профессор Университета Женевы, из сообщения в Женевском медицинском сообществе.
Гематоэнцефалический барьер
Наша нервная система в структуре головного мозга отделена от кровеносных сосудов гематоэнцефалическим барьером (ГЭБ). Он представляет собой трехслойный «чехол» капилляров из эндотелия, перицитов и астроцитов.
Схематическое изображение строения гематоэнцефалического барьера. Источник: И.Мартынов. «Мозг. Как он устроен и что с ним делать».
Эндотелиальные клетки, образующие первую защиту, имеют плотный контакт друг с другом, намного меньший, чем между такими же клетками в других частях организма. Соседние клетки черепицеобразно накладываются друг на друга, а в местах стыка их закрепляют пластины.
Но эндотелиальный слой не является полностью непроницаемым. В нем есть открытые участки (50нанометров) и межклеточные щели (от 100 до 1000нм).
Только некоторые вещества и микроорганизмы могут проникнуть сквозь них. А те, которые преодолеют первый слой, остановятся перицитами, составляющими второй, и астроцитами звездообразной формы.
Последние соединяются своими отростками и закрепляют структуру.
Таким образом капилляры в головном мозге окружены своеобразным футляром. Этот защитный механизм возник в процессе эволюции для предотвращения проникновения микроорганизмов, патогенов и токсинов в мозг и нервную систему.
Что и как может преодолевать ГЭБ
У здорового человека мозг стерилен. Но некоторые микроорганизмы и вещества могут проникать через ГЭБ. Это многие бактерии (менингококки, пневмококки и др), вирусы, опухолевые клетки, ядовитые и сильнодействующие вещества (например, алкоголь, морфий и др.)
Для того, чтобы преодолеть ГЭБ, веществам необходимо соединиться со специальными белками-транспортерами, осуществляющими их перенос сквозь отверстия и мембраны барьера.
При повреждении ГЭБ в мозг могут проникать те клетки, вещества и патогены, которые при его целостности не смогли бы. Многие патогены провоцируют воспаление ГЭБ, чтоб нарушить его непроницаемость и проникнуть внутрь.
Так, например, коронавирус с помощью спайкового S-белка (т.н. шип) вызывает провоспалительную реакцию эндотелиальных клеток, а раковые клетки выделяют ферменты или микроРНК для нарушения структуры плотных контактов.
Но, задерживая многие патогены и токсины, барьер не пропускает также иммуные клетки. иммунная система, контролирующая весь остальной организм, в головном мозге и нервной системе не действует.
Как же мозгу и нервной системе без иммунитета организма справляться со всеми патогенами и токсинами?
Микроглия: на страже мозга
Долгое время считалось, что в мозге нет ничего, что могло бы выполнять функции отсутствующих в нем иммунной и лимфатической системы (лимфа тоже не распространяется на мозг). При этом велись поиски собственной защиты мозга и системы выведения продуктов метаболизма.
Функции иммунной системы в мозге выполняет микроглия. Связь в названии с глией – вспомогательной тканью мозга – сложилась исторически, когда считали микроглию ее производной. Но позже выяснилось, что микроглиоциты имеют иное строение, а название так и осталось закрепленным.
Микроглия не только формирует и поддерживает связи между нейронами, но и распознает микроорганизмы, проявляя качества макрофага: т.е. поглощает и уничтожает патогены. Помимо них, клетки микроглии удаляют отмершие клетки и слабые синапсы (контакты нейронов).
Иллюстрация нейробиолога-художника Эммы Воуn ( Emma Vought, Medical University of South Carolina). Изображен микроглиальный фагоцитоз: клетка микроглии уничтожает нейрон, поврежденный стрессом.
Кроме уничтожения патогенов, защитная функция микроглии проявляется в поддержании целостности ГЭБ. Если в структуре барьера возникают повреждения, микроглия запускает его восстановление.
Клетки микроглии приостанавливают также процесс прионных болезней — заболеваний, вызванных особыми инфекционными патогенами, которые представляют собой белки с аномальной структурой.
Клетки микроглии в зародыше развиваются из тех же клеток-предшественников, что и другие иммунные клетки . В процессе эмбрионального развития данные клетки перемещаются в формирующуюся центральную систему и развиваются отдельно там, отличаясь от дальнейшего развития других иммунных клеток организма.
Контакт с периферическими иммунными клетками
Иммунные клетки могут при некоторых обстоятельствах проникать в мозг и взаимодействовать с собственно иммунными клетками мозга. Например, при повреждении сосудов мозга (травма, инсульт и т.п.) микроглия быстро покрывает их собой.
Через некоторое время в поврежденный мозг проникают периферические иммунные клетки (моноциты, нейтрофилы или миеломоноцитарные клетки).
Данные клетки нужны для восстановления на этом этапе: моноциты работают вместе с микроглией, восстанавливая поврежденную сосудистую сеть. Но если они быстро в очень большом количестве поступают в мозг, то есть опасность развития отека, т.к.
каждая прибывающая клетка открывает отверстие в сосудистой сети, через которое в мозг поступает жидкость.
Когда иммунитет поражает собственный организм
Соединение двух систем иммунитета способно также запустить аутоиммунные реакции, когда иммунные клетки начинают уничтожать клетки своего же организма.
Если имммунные клетки проникнут в мозг, они могут воспринимать белки клеток мозга как чужеродные. Нейроны очень чувствительны к воздействию иммунных факторов и такие проникновения могут вызвать воспалительные заболевания мозга.
Одним из аутоиммунных заболеваний нервной системы является рассеянный склероз — разрушение миелиновой оболочки отростков нейронов.
ГЭБ становится более проницаемым под воздействием воспалительных молекул (цитокинов). Их способны продуцировать все иммунные клетки, в том числе и микроглия.
В ответ на цитокины клетки эндотелия производят молекулы сцепления, к которым присоединяются иммунные клетки.
Они в большом количестве проникают в ткани мозга и, не умея распознавать и игнорировать белки нервной системы запускают синтез антител, атакующих миелин, вследствие чего разрушается миелиновая оболочка аксонов.
Различается ли микроглия у мужчин и женщин?
По данным из публикации: Нейроиммунология и Нейровоспаление 2020; 7: 13-22., автор Наталья Янгуас-Касас, Группа исследования лимфомы, НИИ здоровья Пуэрта-де-Йерро — Сеговия-де-Арана (IDIPHISA)
Донна Верлинг, нейрогенетик из Калифорнийского университета, и ее коллеги обнаружили, что гены, связанные с микроглией, за несколько месяцев до рождения более активны в мужском мозге, чем в женском.
Глимфатическая система
Описание глимфатической системы ученым М.Недергаардом в 2012г перечеркнуло старое предположение, что каждая клетка мозга справляется с отходами метаболизма своими силами. Название системе дано по аналогии с лимфатической системой и от глии — ткани данной структуры.
Глимфатическая система так же, как и лимфатическая во всем организме, удаляет метаболиты из мозга, а также распределяет в мозге глюкозу, аминокислоты, нейромедиаторы и пр . Она осуществляет это, перекачивая спинномозговую жидкость через ткани головного мозга и вымывая таким образом «отходы».
Спинномозговая жидкость проходит в полость вокруг артерий (периартериальное пространство), продвигаясь вперед за счет пульсации сосудов. Затем через канальцы проходит в астроциты, а из них — сквозь ткань мозга.
Собрав отходы из ткани мозга, жидкость проникает в полость вокруг вен (перивенозное пространство), которые выводят кровь из мозга. Глимфатическая система соединяется с лимфатической системой остальной части тела в твердой мозговой оболочке.
Далее жидкость попадает в лимфатическую систему, а из нее — в кровь.
Глимфатическая система лучше работает во время сна и чем глубже сон, тем лучше. Мозг очищается от токсичных веществ, образующихся и накопленных во время бодрствования. Во сне расширяется межклеточное пространство и жидкость по нему циркулирует свободнее.
Во время бодрствования же из-за активности нейронов ткань мозга замедляет поток жидкости, а, следовательно, и удаление вредных молекул. По результатам многих исследований, лучше система очищалась во время сна на боку.
Несмотря на свое отделение от общего иммунитета, головной мозг и ЦНС имеют собственную систему защиты и очистки. Исследование ГЭБ и микроглии сопряжено со многими трудностями.
В их числе препятствия по изучению данных структур на живых людях. Модели на животных не могут полностью служить подобием человеческих органов и процессов его физиологии. Также используются модели, выращенные на органах-чипах, с использованием человеческих клеток. Дополнением является компьютерное моделирование.
Хотя они и не являются исследованиями непосредственно в живом человеке, но все же дают много информации для расширения наших знаний о работе иммунитета мозга.
Пока еще есть достаточно «белых пятен» в функционировании микроглии и глимфатической системы. Но с возрастанием исследований в данном направлении будут получены ответы, раскрывая тайны мозга и иммунитета.
Влияние головного мозга на иммунитет
Не так давно учеными было выявлено, что головной мозг и иммунитет связаны. Хотя до начала XIX века считали, что этот орган полностью изолирован от процессов, происходящих в иммунной системе. Учеными было доказано, что несмотря на обособленность, мозг нуждается в иммунной системе. Точно также он в определенной степени управляет иммунитетом.
Роль костного мозга в иммунной системе
Для начала разберемся от чего в первую очередь зависит правильное функционирование иммунной системы. Не нужно быть ученым, чтобы понимать, что иммунитет – это основной механизм защиты организма от вредоносных агентов. Один из центральных органов иммунной системы – красный костный мозг. В-лимфоциты – то, что вырабатывает костный мозг для иммунитета. Эти клетки необходимы непосредственно для устранения инфекций в организме. Они тесно связаны с Т-лимфоцитами, образующимися в вилочковой железе. Функцией этих клеток является обеспечение клеточного иммунитета. В красном костном мозге также созревают макрофаги, необходимые для захвата крупных инородных частиц и последующего их уничтожения. Если возникает патология костного мозга, иммунитет организма страдает. Можно сказать, если нет костного мозга, нет и иммунитета. Но можно ли также утверждать про головной мозг?
Какие составляющие иммунной системы присутствуют в головном мозге?
Из-за наличия гематоэнцефалического барьера, мозг называют привилегированным органом, отделенным от иммунной системы. Этот барьер отделяет его ткани от крови, наполненной иммунными клетками и молекулами.
Но данный факт не указывает на полное отсутствие связи между головным мозгом и иммунитетом. Просто реакции на инфекции в этом органе происходят по-другому.
А чувствительность к различным повреждениям объясняет слабость ответа на заражение.
Факт того, что в мозге присутствуют составляющие врожденного и приобретенного иммунитета, доказан. Орган состоит из клеток. Нейроны выступают генераторами и распространителями электрических сигналов. Клетки глии выполняют функцию обеспечения нейронов информацией, необходимой для функциональной активности.
Микроглии зарождаются в стволовых клетках и попадают в мозг на ранних этапах его развития. Они представляют собой изолированные макрофаги мозга, удаляющие погибающие нейроны и нервные окончания. Когда мозг созревает, важность этих процессов велика.
Не менее необходимая функция клеток микроглии – защита мозговых тканей от инфекционных агентов.
В мозге есть не только иммунные клетки микроглии. В 2015 году группа ученых Вирджинского университета исследовала мозг мыши. Они обнаружили наличие «лимфатического дренажа», который состоит из каналов, собирающих лимфу и спинномозговую жидкость от мозговых оболочек.
Гипотеза о том, что в мозге человека есть аналогичный механизм, подтвердилась в 2017 году, когда научная группа во главе с доктором Дэниэлом Рэйхом провела ряд экспериментов.
Исследования с помощью магнитно-резонансной томографии показали, что в мозговых оболочках людей и обезьян есть лимфатические сосуды.
Молекулы иммунитета, как и клетки, непосредственно влияют на нормальную работу мозга. Сигнальная молекула цитокин IFN- защищает от вирусов и регулирует социальное поведение. Учеными выявлено, что нехватка цитокина провоцирует социальные расстройства и нарушение нейронных связей.
Противовоспалительной активностью обладает и сигнальная молекула IL-1. Она действует локально или системно, возбуждает повышение температуры, нарушение сна, снижение аппетита и реакции эндокринной системы на атаку организма инфекциями.
Сигнальная молекула C1q отмечает погибающие нейроны и нервные окончания, что помогает клеткам микроглии найти их и удалить.
В связи с известной на сегодняшний день информацией о присутствии компонентов врожденного и приобретенного иммунитета в головном мозге возникает вопрос, почему иммунный ответ в этом органе развит так слабо? Дело в том, что иммунитет здесь работает локально и не столь интенсивно. Имеющиеся клетки могут захватить вредоносные бактерии, но не могут передать информацию лимфоцитам. А привлечение иных клеток становится невозможным, так как этому препятствует гематоэнцефалический барьер.
Как мозг управляет иммунитетом?
На сегодняшний день нельзя сказать, какая часть мозга отвечает за иммунитет. Однако американскими биологами доказана связь на уровне «бактерия-мозг-тело». Пытаясь ее найти, ученые из трех крупнейших университетов, изучали эмбрионы лягушки. Эксперименты показали, что не получая мозговых сигналов, иммунные клетки движутся хаотично и в полной мере не способны противостоять инфекциям.
Ученые сравнивали поведение обычных эмбрионов лягушки с эмбрионами, у которых удален мозг. У последних иммунные клетки не концентрировались в месте повреждения или инфекции, а вели себя беспорядочно, что приводило к быстрому развитию заражения. У эмбрионов с мозгом клетки иммунитета сразу направлялись к месту заражения и начинали бороться с бактериальной угрозой.
Весьма впечатляющие результаты показал эксперимент с заражением кишечной палочкой. У нормальных эмбрионов выживаемость составила 50%. Тогда как из эмбрионов с удаленным мозгом выжило только 16%. При том что состав и количество иммунных клеток был одинаков, такой эффект можно было связать только с отсутствием мозгового сигнала о направлении движения к месту присутствия инфекционного агента.
У эмбрионов без головного мозга отсутствовал такой нейротрансмиттер, как дофамин. Это сигнальное химическое вещество, используемое в мозге для обучения и мотивации.
В результате у эмбрионов без мозга отсутствовал эффект кворума иммунных клеток в месте заражения.
Так, можно сделать вывод о том, что дофамин крайне необходим на ранних стадиях инфекции, с его помощью иммунные клетки понимают, в каком месте нужно концентрироваться.
Таким образом, хоть связь мозга и иммунитета еще не изучена в полной мере, мы знаем, что она точно есть. И можно предположить, что чем лучше работает мозг, тем лучше функционирует иммунная система.
Развивайте способности мозга, ежедневно заставляйте его работать, решать простые и сложные задачи, и будьте здоровы! А отличным вспомогательным средством в развитии мозга станут тренажеры и обучающие курсы Викиум.
Тренируйте память, внимательность, реакцию и становитесь умнее вместе с нами!
Читайте нас в Telegram — wikium
Иммунитет и работа мозга тесно связаны
Все мы знаем о том, что основная функция иммунной системы – это защита от инфекций, бактерий и онкологических процессов. Однако, на протяжении долгого времени ученые считали, что периферическая иммунная система и головной мозг не связаны между собой. Причиной для такого предположения явился тот факт, что головной мозг и иммунная система отделены друг от друга гематоэнцефалическим барьером. Фактически это физиологический барьер между центральной нервной системой и кровеносной системой, и главная функция этого барьера – поддержание гомеостаза мозга.
Дело в том, что иммунная система воспринимает клетки мозга, как чужеродные.
Все основные процессы работы иммунной системы происходят в крови: именно там циркулируют бактерии и вирусы, и именно туда выделаются защитные иммунные клетки, чтобы им противостоять.
Мозг должен быть огражден от этих процессов, и для этого и нужен гематоэнцефалический барьер. Этот барьер прекрасно защищает мозг от различных патологий и токсических веществ.
В связи с этим ученые и были убеждены в том, что иммунная система и головной мозг не связаны между собой. Но, как показали последние исследования, это утверждение не верно.
Исследования были проведены независимо друг от друга, и в одном из них была подвергнута анализу кровь 500 пациентов на наличие эпигенетических профилей. В результате анализа было выяснено, что такой профиль существует, и он зависит от толщины коры головного мозга.
Особенно важна при этом та зона коры, которая отвечает за когнитивные функции. Помимо этого ученые выяснили, что данные гены участвуют в регуляции иммунной функции крови.
Во время второго эксперимента целью ставилось исследование генома взрослого человека с очень хорошей, или, наоборот, очень плохой памятью на изображения негативного содержания.
В ходе эксперимента оказалось, что ген TROVE2, участвующий в иммунных патологиях, влияет на способность запоминать множество негативных изображений.
Помимо этого данный ген несет ответственность за работу тех отделов мозга, которые отвечают за хранение в памяти эмоциональных переживаний.
В результате этих исследований ученые пришли к предварительному выводу, что прием препаратов для поддержания иммунитета может благотворно влиять на деятельность мозга.
Мозг лечит, бессонница калечит — Газета.Ru
Человеческий мозг напрямую связан с иммунной системой, а недостаточное количество сна может привести к болезни Альцгеймера, выяснили ученые. Почему в Древнем Египте мозг мумий не сохраняли и может ли медитация помочь восстановиться после болезни, рассказывает отдел науки «Газеты.Ru».
Когда-то люди не задумывались о том, как головной мозг управляет телом, полагая, что этот орган, в общем-то, весьма бесполезный. Так, в Древнем Египте при приготовлении мумий в теле сохранялись все органы, кроме мозга, который считался ненужным ни для жизни, ни после смерти.
Тогда предполагалось, что место рациональной души — в сердце, а не под черепной коробкой. И только позднее появились представления, что головной мозг является средоточием ощущений и мышления, а Платон помещал туда и бессмертную часть души.
Впоследствии врачи и ученые выяснили, что вместилище нейронов в голове выполняет весьма критические для всего организма функции.
Однако до сих пор мозг представляется так или иначе «живущим своей жизнью» органом, управляющим организмом «из-за кулис» и страдающим от собственных, не касающихся других систем органов патологий.
Так, с точки зрения иммунологии головной мозг рассматривается как иммунопривилегированный орган, который иммунная система как бы обходит стороной, предоставляя ему самому справляться с вторжением патогенов.
Им не так-то просто пробраться в мозг из других тканей благодаря наличию гематоэнцефалического барьера, надежно отделяющего среду мозга от остальной среды организма.
Возможно, именно этой парадигмой «отделенности» мозга от тела и руководствуются врачи, позитивно смотрящие на возможность операции по пересадке головы, предложенной итальянским нейрохирургом Серджио Канаверо.
По мнению сторонников операции, недоступность мозга для иммунокомпетентных клеток сильно упрощает терапию, в ходе которой иммунная система подавляется для предотвращения отторжения организмом пересаженной части тела. Впрочем, никаких доказательств осуществимости этой операции ни сам хирург, ни его сторонники пока не представили.
Однако последние исследования кардинально меняют понимание принципов взаимодействия мозга и иммунной системы. Ранее считалось, что в мозге нет лимфатических сосудов, поэтому этот орган не может сообщаться с периферической лимфатической системой, в которой циркулируют T- и B-лимфоциты — основные эффекторы адаптивного иммунитета.
Также до последнего времени было непонятно, как самый метаболически активный орган справляется с удалением потенциально токсичных побочных продуктов, ведь их отток из межклеточной жидкости в других органах происходит через сосуды лимфатической системы.
Но теперь многое прояснилось. Учеными из Университета Виргинии в США были обнаружены лимфатические сосуды в мозговых оболочках, аналогичные лимфатическим сосудам других частей тела.
А учеными из медицинского центра Рочестерского университета было описано функционирование так называемой глимфатической системы головного мозга — ее работа напрямую связана с циклом «сон – бодрствование»: ученые доказали, что во время сна пространство между клетками мозга расширяется за счет уменьшения объема этих клеток, что способствует притоку спинномозговой жидкости. Она уносит за собой накопленные за день продукты распада, фильтруясь затем в лимфатических сосудах мозговых оболочек. Нарушения функционирования этих дренажных систем мозга могут приводить, например, к болезни Альцгеймера, одна из причин возникновения которой связана с накоплением в мозге бета-амилоида.
Важно подчеркнуть, что именно сон является значимым посредником в регуляции «общения» мозга и иммунной системы. Это состояние может рассматриваться как компонент острой фазы иммунного ответа.
В филогенезе иммунная система и сон оказывали друг на друга значительное влияние.
Брайан Престон и другие исследователи из Института эволюционной антропологии Макса Планка проследили положительную корреляцию между временем сна и количеством лейкоцитов у 26 видов млекопитающих.
Также было показано, что увеличение продолжительности сна сопряжено с более эффективной защитой от паразитов.
Из результатов многочисленных исследований однозначно следует вывод: между мозгом и периферической иммунной системой есть явные двусторонние функциональные и анатомические связи.
Значит, можно предположить, что любое нарушение работы мозга так или иначе повлияет на работу иммунной системы и наоборот.
Ученые из Кембриджского университета показали, что у больных шизофренией по сравнению со здоровыми испытуемыми наблюдается особенный набор характеристик лимфоцитов, которые могут быть легко измерены биомаркерами психотических состояний.
Это исследование поможет в будущем определять, как именно протекает заболевание, при помощи изучения иммунофенотипа больного.
Если у мозга такие тесные связи со всем организмом, то возможно ли вылечить себя силой мысли? Оказывается, образ наших мыслей может оказывать влияние даже на ДНК. Группа канадских ученых исследовала влияние медитации и терапии в группах поддержки у больных раком молочной железы.
Известно, что у таких больных концевые участки хромосом — теломеры — становятся короче, чем у здоровых людей.
У тех пациентов, кто проходил 12-недельную терапию в группах поддержки или 8-недельный курс медитации, теломеры сохраняли свою длину по сравнению с контрольной группой пациентов, которым был предложен только 6-часовой семинар по борьбе со стрессом, — у них теломеры, как правило, за истекшие недели укорачивались.
Впрочем, не стоит полагать, что медитация помогала вылечить рак: минимум за три месяца до исследования все пациенты успешно прошли полноценный курс лечения от злокачественной опухоли и на момент проведения психологических экспериментов проходили реабилитацию после него.
Возможно, сознанию действительно доступно исцеление собственного организма, а наше мышление может непосредственным образом влиять на процессы, происходящие в организме, вплоть до клеточного уровня.
Дальнейшее изучение взаимодействий между мозгом и периферическим системами может открыть новые подходы к лечению множества неврологических заболеваний наряду с системными функциональными нарушениями организма, а также пролить свет на механизмы функционирования самого мозга.