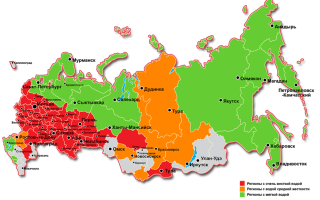
Жесткость воды — одно из важнейших свойств, имеющее большое значение при водопользовании.
Если в воде находятся ионы металлов, образующие с мылом нерастворимые соли жирных кислот, то в такой воде затрудняется образование пены при стирке белья или мытье рук, в результате чего возникает ощущение жесткости.
Жесткость воды пагубно сказывается на трубопроводах тепловых сетей, приводя к образованию накипи. По этой причине в воду приходится добавлять специальные «смягчающие» химикаты.
Жесткость воды обусловлена присутствием растворимых и малорастворимых солей-минералов, главным образом кальция (Са2+) и магния (Mg2+). Кроме указанных, к солям жесткости относят также соли стронция (Sr2+), цинка (Zn2+) и др., однако в поверхностных и грунтовых природных водах из перечисленных катионов в заметных концентрациях присутствуют только кальций и магний.
Суммарная жесткость воды, то есть общее содержание растворимых солей кальция и магния, получила название «общей жесткости». Ввиду того, что солями жесткости являются соли разных катионов, имеющие разную молекулярную массу, концентрация солей жесткости, или жесткость воды, измеряется в единицах эквивалентной концентрации — количеством г-экв/л или мг-экв/л.
При жесткости до 4 миллиграмм эквивалент/литр вода считается мягкой; от 4 до 8 миллиграмм эквивалент/литр — средней жесткости; от 8 до 12 миллиграмм эквивалент/литр — жесткой; более 12 миллиграмм эквивалент/литр — очень жесткой.
В различных регионах России жесткость поверхностных и грунтовых вод отличается: преимущественно мягкие воды географически приурочены к районам севера Европейской части России, а также Восточной Сибири. В центре и на юге Европейской части России, а также в южных регионах Западной Сибири вода преимущественно жесткая.
В естественных условиях ионы кальция, магния и других щелочноземельных металлов, обусловливающих жесткость, поступают в воду в результате взаимодействия растворенного диоксида углерода с карбонатными минералами и других процессов растворения и химического выветривания горных пород.
Источником этих ионов являются также микробиологические процессы, протекающие в почвах на площади водосбора, в донных отложениях, а также сточные воды различных предприятий.
Различные типы пород, залегающих на территории водосборов, а также взаимосвязанные с ними свойства почвенного покрова непосредственно обуславливают различия в жесткости вод в регионах нашей страны.
Воздействие жесткости на организм
Поиск причинно-следственных связей между жесткостью воды и сердечно-сосудистой патологией был результативным. В ряде исследований установлена статистически достоверная, хотя и не тесная, обратная корреляционная связь между жесткостью воды и частотой инфаркта миокарда.
Поскольку в других, не менее тщательно выполненных исследованиях, такой связи не было установлено, считается, что патогенетическим агентом могли быть не сами соли жесткости, а коррелирующие с ними какие-либо другие микроэлементы.
Что касается других проявлений вредного влияния жестких вод, то статистическими исследованиями установлено и экспериментально подтверждено их влияние на частоту возникновения мочекаменной болезни. В этом случае не идет речи о прямой детерминированности степени жесткости воды и заболеваний мочекаменной болезнью.
Решающую роль играют другие сопутствующие факторы, в частности состояние минерального обмена конкретного человека, потребляющего жесткую воду. Высокое содержание в питьевой воде солей кальция и магния является фактором риска мочекаменной болезни.
Воздействие жесткости на сантехнику
Воздействие повышенной жесткости воды на контактирующие с ней приборы и сантехнику приводят к следующим последствиям:
- в водопроводных трубах и радиаторах отопления образуются известняковые отложения (что уменьшает поперечный просвет труб системы отопления и ухудшает ее теплообменную функцию);
- на нагревательных элементах бытовых электроприборов (стиральных и посудомоечных машин, электрочайников и др.) образуется известковый налёт;
- жёсткая вода непригодна для использования в пищевом и химическом производстве;
- при стирке жёсткой водой сложно достигнуть эффекта отбеливания, невозможно качественно отполоскать бельё, что приводит к потере исходного цвета ткани: белые ткани приобретают сероватый оттенок, цветные – тускнеют.
Жёсткость воды из-за образующихся отложений негативно влияет на котельное оборудование. В России введены строгие требования к качеству воды по жёсткости для котлов ТЭЦ, электростанций, промышленных водонагревателей. Поэтому умягчение воды (водоподготовка) является в этом случае обязательным условием.
Способы умягчения воды
Умягчение воды может быть осуществлено следующими основными способами:
- реагентным;
- катионитовым;
- термическим.
Нередко представляется целесообразным комбинировать эти способы, удаляя часть солей жесткости реагентным способом, а остаток их — катионированием, либо применять реагентный способ в комбинации с термическим способом умягчения воды.
Из реагентных способов умягчения наиболее распространен известково-содовый способ. Сущность его состоит в переводе растворенных в воде солей Са2+ и Mg2+ в малорастворимые СаСОз и Mg(OH)2, выпадающие в осадок.
Катионитовый способ умягчения воды заключается в фильтровании жесткой воды через мелкозернистую загрузку некоторых веществ (сульфоуголь, искусственные смолы).
Эти вещества обладают способностью обменивать катионы содержащегося в них натрия Na+ или водорода Н+ на катионы кальция Са2+ или магния Mg2+ солей жесткости, растворенных в воде.
Таким образом, различают процесс Na-катионирования и Н-катионирования.
Когда обменная способность катионитового фильтра исчерпана, производят регенерацию катионитовой загрузки. Na-катионитовые фильтры регенерируются раствором поваренной соли NaCl, а Н-катионитовые — растворами серной H2SO4 или соляной HCl кислот.
Вода после Na-катионитовых фильтров обычно имеет повышенную щелочность (рН>7), а после Н-катионитовых — повышенную кислотность (рН
Диагностика аутоиммунных заболеваний и синдромов
Антиядерные (антинуклеарные) антитела, ANA — (от англ. anti-nuclear antibodies; в России широко распространен менее удачный синоним — АНФ, антинуклеарный фактор, который не отражает давно установленную биологическую природу явления) — антитела против основных компонентов ядра клетки (нуклеопротеиды, белки хроматина и др.).
При системных аутоиммунных заболеваниях, а также в процессе развития многих других патологических состояний происходит сенсибилизация лимфоцитов к собственным белкам организма и вырабатываются аутоантитела, направленные против антигенов компонентов клеточных ядер и цитоплазмы.
Образующиеся иммунные комплексы аутоантиген-аутоантитело откладываются на базальных мембранах различных тканей и органов (кожа, почки, синовиальные, серозные оболочки, мозг и т. п.), а также снабжающих их кровью сосудов, активируя систему комплемента и вызывая воспаление и повреждение тканей.
При этом повышается лизосомальная активность, выделяются медиаторы воспаления. Цитотоксическое действие оказывают фиксируемый иммунными комплексами комплемент и сенсибилизированные лимфоциты. Поражение сосудов на уровне микроциркуляторного русла лежит в основе системного повреждения соединительной ткани и паренхиматозных органов.
https://www.youtube.com/watch?v=RumiHAPnHu0
Исследование на антиядерные антитела проводят, если возникает подозрение на аутоиммунное заболевание или присоединение аутоиммунного компонента, играющего существенную роль в патогенезе многих нозоформ.
Тест на ANA высокочувствителен (до 98%) при системной красной волчанке, однако положительные результаты могут наблюдаться при других коллагенозах и иммунокомплексных заболеваниях, а также при прочих заболеваниях, протекающих с развитием аутоиммунного компонента.
Результаты теста, полученные в разных лабораториях, могут отличаться вследствие особенностей использующихся методов. Поэтому полноценный лабораторный ответ при исследовании антинуклеарных антител обязательно должен включать описание использованного метода.
Очень обширный перечень антигенов, объединенных в понятие «ядерные», требует также обязательного уточнения, антитела к каким из них могут быть выявлены используемым методом, а к каким — не могут.
Иммунофлюоресцентные методы, в которых в качестве субстрата используются животные клетки, позволяют, помимо антиядерных антител, выявлять и дифференцировать также антитела к некоторым компонентам цитоплазмы, что расширяет их возможности.
Показания к назначению анализа: диагностика и дифференциальная диагностика системных заболеваний соединительной ткани (особенно СКВ), аутоиммунного гепатита, вирусного гепатита с аутоиммунным компонентом (индуцированным вирусами или лечебными вмешательствами), первичного билиарного цирроза, рассеянного склероза; выявление аутоиммунного компонента при различных заболеваниях, в патогенезе которых может играть роль аутоагрессия. Материал для исследования: сыворотка крови.
- Для определения антинуклеарных антител используется методика непрямой иммунофлюоресценции с использованием в качестве субстрата клеток культивируемой линии Нер-2.
- Все вышеперечисленные особенности обязательно отражаются в лабораторном заключении, где, помимо указания типа свечения и соответствующего ему наиболее вероятного типа антител, даются также рекомендации по трактовке результатов в смысле возможной ассоциации с конкретными нозоформами или синдромами, а также необходимые дополнительные лабораторные исследования.
- Достоинством метода иммунофлюоресценции с использованием клеток злокачественных культивируемых линий является также возможность выявления антител к некоторым антигенам цитоплазматической локализации: митохондриям, актину, лизосомам и др.
Образец (исследуемая сыворотка крови) инкубируется с субстратом, если в сыворотке присутствуют аутоантитела к ядерным или цитоплазматическим антигенам, они связываются с соответствующими компонентами субстрата с образованием комплекса антиген-антитело, который выявляется конъюгатом — антителами против иммуноглобулинов человека, меченными ФИТЦ. В результате при изучении с помощью люминесцентного микроскопа выявляется специфическая флюоресценция соответствующих ядерных или цитоплазматических структур клеток. Использование в качестве субстрата клеток злокачественной культивируемой линии благодаря их особенностям (высокое ядерно-цитоплазматическое соотношение, крупные размеры, наличие большого количества митозов) позволяет оценить различные типы свечения, характерные для присутствия в образце крови широкого спектра антител к различным антигенам, имеющих различные клинические ассоциации.Следует иметь в виду, что часть из определяемых типов свечения является высокоспецифичной, четко ассоциирована с определенными заболеваниями и имеет вполне определенную диагностическую значимость, в особенности при выявлении в высоких титрах; однако некоторые антитела к различным антигенам могут давать сходные типы свечения, в таких случаях может требоваться дальнейшее обследование для уточнения конкретного антигена, к которому направлены аутоантитела. С другой стороны, определенный тип антител может встречаться при нескольких нозологических формах. Существуют также антитела (они встречаются редко), реагирующие исключительно с компонентами веретенного аппарата клеток; обычно они не связаны с аутоиммунными заболеваниями, и их обнаружение расценивается как ложнопозитивный, не имеющий клинических ассоциаций результат.Некоторые из выявляемых антиядерных и антицитоплазматических антител с характерными для них видами свечения и клиническими ассоциациями приведены ниже:
- ядерный гомогенный тип — антитела (АТ) к ДНК (двух- и односпиральной), антитела к ДНП (дезоксинуклеопротеид — комплекс ДНК с гистонами), антитела к гистонам, антитела к другим компонентам хроматина (протамины и т.д.); клинические ассоциации — СКВ (анти-ДНК, антитела к гистонам — в высоких титрах); лекарственная волчанка, ревматоидный артрит (антитела к гистонам);
- ядерный периферический тип — АТ к двухспиральной ДНК, гистонам; клинические ассоциации — СКВ, лекарственная волчанка);
- ядерно-мембранный ламиновый тип — АТ к ламинам (фибриллярным белкам мембраны ядра); клинические ассоциации — СКВ, линейная склеродермия, ревматоидный артрит, сочетанный синдром гепатит/тромбопения/анемия;
- ядерно-мембранный кольцеобразный тип с крапчатым свечением цитоплазмы — антимитохондриальные антитела к компонентам митохондрий М2 (пируватдегидрогеназный комплекс), М3, М6; клинические ассоциации см. митохондриальный тип;
- ядерные каналы — АТ к белкам комплекса канальцев ядерной мембраны; клинические ассоциации — полимиозит;
- перихроминовый тип — АТ к перихромину; клинические ассоциации — СКВ;
- гетерогенный ядерный РНП (рибонуклеопротеин) — АТ к различным компонентам матрикса ядра; клинические ассоциации — смешанное заболевание соединительной ткани (СЗСТ);
- Sm/РНП — АТ к ядерному РНП или Sm-комплексу; клинические ассоциации — СКВ, СЗСТ (антитела к Sm); синдром Шегрена, склеродермия, ревматоидный артрит, СКВ, дискоидная волчанка, вызванная прокаинамидом (антитела к РНП);
- центромерный тип — АТ к центромере (кинетохору); клинические ассоциации — синдром CREST (кальциноз, феномен Рейно, дисфункция пищевода, склеродактилия, телеангиэктазия), склеродермия, первичный билиарный цирроз
- ядерный крапчатый тип (NSP1) — АТ против слабо охарактеризованных белков, часто сочетающиеся с антителами к актину или митохондриям; клинические ассоциации — первичный билиарный цирроз (NSP1 + митохондриальный тип), хронический активный гепатит (NSP1 + актин);
- ядрышковый гомогенный тип — АТ к нуклеолину и другим компонентам ядрышек; клинические ассоциации — сочетанный синдром полимиозита/склеродермии, склеродермия в основном с поражением почек;
- ядрышково-кластерный тип — АТ к фибриллярину (7-2-РНК), антитела к рибонуклеопротеину U3РНП; клинические ассоциации — склеродермия, обнаруживаемая в основном у молодых мужчин;
- ядрышково-крапчатый тип — АТ к Scl-70 (АТ к топоизомеразе 1); клинические ассоциации — склеродермия;
- митохондриальный (цитоплазматический) тип — АТ к М2 (пируватдегидрогеназный комплекс), М3, М6 компонентам митохондрий (антитела к М1 и М5 на клетках Hep-2 не выявляются); клинические ассоциации — первичный билиарный цирроз, лекарственная СКВ (антитела к М3, М6), хронический активный гепатит, синдром Рейнольдса, синдром Шегрена, ревматоидный артрит;
- мелкокрапчатый (цитоплазматический) тип — АТ к различным цитоплазматическим белкам, например, SPR (signal recognition particle — частица, распознающая сигнал); клинические ассоциации — миозит;
- перинуклеарный тип — АТ к антигенам Jo-7, PL1, PL7, PL12; клинические ассоциации — полимиозит, в основном в сочетании с соединительнотканным заболеванием легких; дерматомиозит;
- рибосомальный тип — АТ к антигенам рибосом; клинические ассоциации — СКВ, в основном с неврологической симптоматикой, ревматоидный артрит, синдром Шарпа;
- актин — АТ к актину (антитела к гладкой мускулатуре); клинические ассоциации — хронический активный гепатит, первичный билиарный цирроз;
- тубулин — АТ к тубулину; клинические ассоциации — алкогольный цирроз, тиреоидит Хашимото, склеродермия, синдром CREST, феномен Рейно;
- цитокератин — АТ к цитокератину; клинические ассоциации — ревматоидный артрит, склеродермия, СКВ.
У здоровых лиц моложе 60 лет следует ожидать отрицательных результатов на антитела к компонентам ядра и цитоплазмы; в низком титре (слабоположительный результат) эти антитела все же обнаруживаются у 2-3% (по некоторым данным, до 10%) практически здоровых людей, однако никогда нельзя предсказать, не разовьется ли у этих людей аутоиммунное заболевание в будущем (так, по данным некоторых авторов, антитела к ДНК начинают выявляться задолго до начала клинических проявлений СКВ, латентный период может продолжаться годами). После 60 лет частота слабоположительных результатов с возрастом постоянно растет. Клиническая значимость этих результатов остается неясной; как правило, они выявляются только в первичном (скрининговом) разведении 1:40. Исходя из этого, при выявлении положительного результата в скрининговом титре 1:40 всегда необходимо титрование, как минимум до диагностического титра 1:80. В любом случае представляется целесообразным последующее регулярное клинико-лабораторное наблюдение лиц, у которых выявлены ANA в низком титре.
ОГРАНИЧЕНИЯ МЕТОДА Положительный результат предполагает наличие определенных заболеваний (см. ниже), однако, как и результат любых лабораторных исследований, может нуждаться в подтверждении или уточнении с помощью других методов, а также в установлении клинико-лабораторных корреляций.
Надо иметь в виду, что различные лекарственные препараты могут вызывать образование аутоантител (гидралазин, прокаинамид, фенитоин, карбамазепин, изониазид, хлорпромазин, пеницилламин, леводофа, пенициллин, фенилбутазон, пероральные контрацептивы, хинидин).
Наиболее частыми мишенями для этих ятрогенных аутоантител являются ядерные гистоны, что приводит к развитию гомогенного или гомогенного периферического типа свечения.
- Системные поражения соединительной ткани:
- — системная красная волчанка (СКВ), — ревматоидный артрит,- синдром Шегрена, — склеродермия,- дерматомиозит,
- — узелковый периартериит и др.
;
- Инфекции (туберкулез, инфекционный мононуклеоз, острый и особенно хронический вирусный гепатит, подострый инфекционный эндокардит, ВИЧ-инфекция и др.);
- Хронический аутоиммунный гепатит, первичный билиарный цирроз печени;
- Сахарный диабет (инсулинзависимый);
- Множественный склероз;
- Легочной фиброз;
- Системные васкулиты.
Антинуклеарные антитела также могут выявляться при острых и хронических лейкозах, приобретенной гемолитической анемии, болезни Вальденстрема, малярии, хронической почечной недостаточности, тромбоцитопениях, лимфопролиферативных заболеваниях, миастении и тимомах.
Титры антинуклеарных антител при узелковом периартериите могут достигать 1:100, при дерматомиозите — 1:500, СКВ — 1:1000 и выше.
При СКВ тест на выявление антинуклеарных антител методом непрямой иммунофлюоресценции обладает высокой степенью чувствительности (до 98% по данным разных авторов), но умеренной специфичностью (78%), так как антинуклеарные антитела могут встречаться и при других, указанных выше, заболеваниях.
Для сравнения, тест определения антител к нативной ДНК с помощью ИФА в диагностике СКВ обладает значительно меньшей чувствительностью — 38% (т.к.
патогенетическую роль в развитии СКВ могут играть не только антитела к ДНК, но и антитела к гистонам, дезоксирибонуклеопротеину и многим другим ядерным антигенам); однако специфичность определения антител к нативной ДНК для диагноза СКВ является почти абсолютной (98%).
Клиническая интерпретация этих различий в чувствительности и специфичности разных лабораторных тестов в диагностике СКВ выглядит следующим образом: отрицательный результат обнаружения антител к нативной ДНК с помощью ИФА не исключает диагноз СКВ, обнаружение же этих антител практически со 100% вероятностью подтверждает диагноз.
Другая ситуация имеется в отношении АНФ: отрицательный (особенно многократный) результат обнаружения антинуклеарных антител методом непрямой иммунофлюоресценции делает диагноз СКВ (во всяком случае, активной формы) весьма сомнительным (т.к. метод обнаруживает практически все аутоантитела, встречающиеся при СКВ), обнаружение же антинуклеарных антител не всегда будет достаточным основанием для постановки диагноза СКВ, оно подтверждает наличие феномена аутоиммунитета и обычно требует для установления окончательного диагноза дальнейшей клинико-лабораторной дифференциации с учетом типа свечения, титра антител, проведения дополнительных уточняющих или подтверждающих тестов, рекомендованных лабораторией, сопоставления результатов с клинической картиной.
При СКВ корреляция между величиной титра ANA и клиническим состоянием обычно отсутствует, хотя сохранение высоких титров в течение длительного времени является неблагоприятным прогностическим признаком.
Снижение уровня антител предвещает ремиссию, но иногда — летальный исход (феномен потребления антител: при нарастающем аутоиммунном повреждении тканей темп высвобождения ядерных антигенов, с которыми связываются наработанные антиядерные антитела, превышает скорость синтеза новых аутоантител).
При склеродермии частота выявления антител к ядерным антигенам составляет 60-80%, их титр обычно ниже, чем при СКВ. При ревматоидном артрите часто встречаются СКВ-подобные формы течения, поэтому довольно часто выявляются ANA.
При дерматомиозите антитела к ядерным антигенам в крови встречаются в 20-60% случаев, при узелковом периартериите — в 17% (титр до 1:100), при болезни Шегрена — в 56% в сочетании с артритом и в 88% случаев — при комбинации с синдромом Гужеро-Шегрена.
При дискоидной (кожной) красной волчанке антинуклеарный фактор выявляется у 50% больных.
Частота обнаружения антинуклеарных антител при ревматическихзаболеваниях и у здоровых лиц (Насонова В.А. и др., 1997)
| Заболевание | Частота выявления ANA, % | Титры |
| СКВ — активная форма | 98-100 | +++ |
| Дискоидная красная волчанка | 40 | ++, +++ |
| Лекарственная волчанка | 100 | ++ |
| Системная склеродермия | 70 | ++, +++ |
| Синдром Шегрена | 60 | ++, +++ |
| Смешанное заболевание соединительной ткани | 100 | ++, +++ |
| Болезнь Рейно | 60 | ++, +++ |
| Ревматоидный артрит | 40 | +, ++ |
| Ювенильный хронический артрит | 20 | +, ++ |
| Полимиозит и дерматомиозит | 30 | + |
| Узелковый периартериит | 17 | + |
| Здоровые лица до 40 лет | 3 | + |
| Здоровые лица после 40 лет | 25 | + |
Диагностика гранулематозных васкулитов (АНФ и АНЦА) в Капчагай
- Приём, исследование биоматериала
- Показания к назначению
- Описание
Приём материала
- Можно сдать в отделении Гемотест
Формат представления результата
Количественный
- При подозрении на гранулематозные васкулиты;
- При наличии жалоб, указывающих на ревматологическую патологию.
Подробное описание исследования
Аутоиммунные васкулиты — группа заболеваний, при которых происходит воспаление сосудистой стенки, не связанное с воздействием токсинов или инфекций. Первичные системные васкулиты являются самостоятельными заболеваниями. К ним относят: гранулематоз Вегенера, синдром Чарджа-Стросс, микроскопический полиангиит — некротизирующий васкулит, повреждающий сосуды маленького калибра.
Гранулематоз Вегенера — системный васкулит, при котором поражаются сосуды мелкого и среднего размера, с преимущественным нарушением работы верхних и нижних дыхательных путей. Причина заболевания неизвестна, хотя имеется связь с предшествующими инфекциями респираторного тракта.
Клинически гранулематоз Вегенера проявляется синуситом, ринитом, носовыми кровотечениями, снижением обоняния, осиплостью голоса. Также обнаруживается поражение легких, проявляющееся кашлем, одышкой, болью в грудной клетке.
Для заболевания в некоторых случаях характерно поражение почек, суставов, лихорадка, снижение аппетита, нарушение органов зрения и слуха, возникновение инсульта, инфаркта.
Синдром Чарджа-Стросс — редкое аутоиммунное заболевание с воспалением сосудов мелкого калибра. Причина его появления не установлена, определенное значение отводится аллергенам и некоторым лекарственным препаратам. Клинически синдром проявляется сыпью преимущественно в локтевых сгибах, инсультами, синуситами, поражением почек.
Лабораторные анализы играют большую роль в диагностике гранулематозных васкулитов, так как поражаются многие органы и системы, клиническая картина неспецифична.
Антинейтрофильные цитоплазматические антитела (АНЦА) — специфичный и чувствительный маркер гранулематозных васкулитов. Нейтрофилы содержат в своем составе гранулы, внутри которых находятся вещества, участвующие в обезвреживании микробов.
К этим веществам относят миелопероксидазу, протеиназу-3, эластазу. При прикреплении АНЦА к этим веществам лейкоциты формируют скопление в сосудах с образованием воспалительных узелков — гранулем, являющихся основным морфологическим признаком гранулематозных васкулитов.
АНЦА служат одним из базовых маркеров данных заболеваний, в связи с чем их также называют АНЦА-ассоциированными васкулитами.
В крови АНЦА обнаруживают методом непрямой иммунофлюоресценции и при этом выделяют несколько типов свечения цитоплазмы в зависимости от вещества внутри гранул, к которому направлено антитело.
Другим важным маркером для диагностики гранулематозных васкулитов является антинуклеарный фактор (АНФ) — совокупность антител к рибонуклеиновым кислотам ядер клеток. Для обнаружения АНФ используют клеточную линию HEp-2, представляющую из себя эпителиоидные клетки. Метод обладает высокой чувствительностью, что позволяет провести точную диагностику.
Таким образом, анализ на выявление АНФ и АНЦА служит важным этапом диагностики гранулематозных васкулитов. Своевременное выявление заболевания позволяет назначить лечение и избежать осложнений.
Что ещё назначают с этим исследованием?
Использованная литература
- Адашева, Т.В., Нестеренко, О.И., Задионченко, В.С. и др. Клинический случай синдрома Чарджа-Стросс: трудности диагностики, терапевтическая тактика. Архивъ внутренней медицины, 2016. — №5. — С. 63-69.
- Ходош, Э.М., Крутько, В.С., Ефремова, О.А.
Гранулематоз с полиангиитом (Вегенера) и системные васкулиты: многосторонний взгляд на проблему (обзор литературы). Актуальные проблемы медицины, 2017. — №19(268).
- Клиническая лабораторная диагностика : национальное руководство. В 2-х т. / под ред. В.В. Долгова, В.В. Меньшикова. — М. : ГЭОТАР-Медиа, 2012. — Т.2 — С.106-108.
- Подготовка к исследованию
- Противопоказания и ограничения
- Кровь сдают утром натощак — после последнего приема пищи должно пройти как минимум 8 часов. Вечером накануне поужинайте легкой нежирной пищей.
- За 2 часа до сдачи крови на анализ нельзя курить, пить кофе и чай, а также фруктовые соки.
Допустимо употребление небольшого количества негазированной воды — не сладкой, не соленой, не минеральной.
- В течение 24 часов до анализа крови нельзя употреблять алкоголь. Также, по согласованию с лечащим врачом, необходимо отменить прием лекарственных препаратов.
- За час до исследования избегайте психоэмоционального напряжения, физического напряжения, такого как быстрый подъем по лестнице, бег. Желательно прийти в отделение лаборатории заблаговременно и в течение 10-15 минут до сдачи крови спокойно посидеть.
- Не сдавайте кровь сразу после физиотерапевтических процедур, массажа и инструментальных обследований, таких как УЗИ и рентген, в течение 5-7 дней.
- Если вы контролируете лабораторные показатели в динамике, постарайтесь сдавать каждый анализ в одно и то же время при одинаковых условиях.
Противопоказания и ограничения
Абсолютных противопоказаний нет.
COVID-19 и болезни органов пищеварения — что надо знать пациенту в период пандемии?
Хотя новая коронавирусная инфекция (COVID-19) наиболее тяжело поражает легкие, сейчас хорошо известно, что эта инфекция характеризуется высокой активностью воспаления, поражением кровеносных сосудов с образованием в них тромбов и поражением различных органов и систем организма.
Желудочно-кишечный тракт – входные ворота для вируса.
Вирус проникает в организм не только через дыхательные пути, но и через клетки желудочно-кишечного тракта и печени, на поверхности которых также обнаружены рецепторы (или входные ворота) для вируса. Поэтому особенностью COVID-19 является высокая частота симптомов со стороны органов пищеварения.
Примерно у 15% больных, переносящих COVID-19, наблюдаются тошнота и рвота, потеря аппетита, послабление стула, боль в животе. Иногда эти симптомы оказываются первыми проявлениями болезни, то есть предшествуют симптомам со стороны дыхательной системы, лихорадке и др.
Именно поэтому экспертами в мире сделано заключение, что все пациенты с впервые появившимися желудочно-кишечными жалобами, должны проходить тестирование на COVID-19.
Кроме того, примерно у 1/3 больных, особенно при тяжелом течении COVID-19, наблюдаются изменения в биохимическом анализе крови, свидетельствующие о поражении печени (повышение АСТ, АЛТ, билирубина, щелочной фосфатазы, гамма-глутамилтрансферазы).
Как правило, все перечисленные симптомы и отклонения самостоятельно проходят при выздоровлении. Однако могут наблюдаться и осложнения -образование эрозий и язв, желудочные кровотечения и другие.
Более высок риск заражения вирусом, а также осложнений этой инфекции у больных, имевших до COVID-19 какое-либо хроническое заболевание органов пищеварения. Кроме того, отрицательное действие на органы пищеварения может оказывать назначаемое сложное лечение COVID-19, в частности нестероидные противовоспалительные (ибупрофен и др.), антибиотики, противовирусные препараты и др.
Как себя вести в период пандемии пациенту с хроническим заболеванием печени и желудочно-кишечного тракта?
В связи с риском более тяжелого течения COVID-19 и развития обострения заболевания пациентам, имеющим хронические заболевания органов пищеварения, необходимо особенно тщательно соблюдать все санитарно-эпидемиологические меры для снижения риска инфицирования.
Таким пациентам показано проведение профилактической вакцинации. Исключение составляют больные аутоиммунными заболеваниями (такими как аутоиммунный гепатит, болезнь Крона, язвенный колит, аутоиммунный панкреатит). В таких случаях пациенту рекомендуется проконсультироваться со специалистом гастроэнтерологом перед принятием решения о вакцинации.
К наиболее уязвимым категориями больных, имеющих более высокий риск осложнений в связи с развитием COVID-19, относятся:
- пациенты с циррозом печени (особенно декомпенсированным), раком печени, пациенты после трансплантации печени
- пациенты с аутоиммунными заболеваниями, получающие иммуносупрессивную (то есть подавляющую иммунные реакции) терапию
- пациенты с неалкогольной жировой болезнью печени, поскольку у них, как правило, имеются такие факторы риска тяжелого течения COVID-19 как ожирение, сахарный диабет, гипертония
- пациенты, имеющие тяжелые эрозивно-язвенные поражения слизистой оболочки пищевода, желудка
Все пациенты групп риска в период пандемии должны продолжать лечение своего основного заболевания, согласованное с лечащим врачом.
В частности, должна быть продолжена терапия противовирусными препаратами хронического гепатита В и С. В случаях впервые выявленного в период пандемии вирусного гепатита противовирусная терапия может быть назначена.
Следует иметь в виду информацию, что некоторые противовирусные препараты (софосбувир и другие), применяющиеся для лечения вирусного гепатита, как показали исследования, оказывают подавляюще действие на COVID-19.
Возможность начала противовирусной терапии или целесообразность отложить ее проведение на постэпидемический период необходимо согласовать с лечащим врачом- гепатологом.
Пациенты с аутоиммунными заболеваниями, получающие иммуносупрессивные препараты (преднизолон, азатиоприн, метотрексат, биологические препараты моноклональных антител и др), должны продолжать лечение, не снижая дозировок и не предпринимая самостоятельных попыток отмены лечения. Наиболее важным для больного является поддержание ремиссии аутоиммунного заболевания. К тому же эта иммуносупрессивная терапия в случаях инфицирования снижает риск развития наиболее тяжелой формы COVID-19, сопровождающейся так называемым цитокиновым штормом.
Особую группу риска представляют больные жировой болезнью печени. Для них критически важно в период пандемии соблюдение диеты с ограничением простых углеводов (мучного, сладкого), соли, ограничение калорийности пищи, исключение алкоголя, регулярные физические нагрузки и продолжение тщательного контроля и лечения сахарного диабета, гипертонии.
Пациентам, страдающим гастроэзофагеальной рефлюксной болезнью (ГЭРБ), хроническим гастритом, язвенной болезнью, в условиях пандемии надо согласовывать с лечащим врачом возможность отложить проведение дополнительных (например, теста на хеликобактер) и плановых (в том числе гастроскопию) исследований. Рекомендованная терапия антисекреторными и защищающими слизистую препаратами должна быть продолжена. Терапию, направленную на устранение хеликобактерной инфекции с применением антибактериальных препаратов, врач может назначить только по срочным показаниям. В большинстве случаев ее целесообразно отложить до разрешения эпидемиологической ситуации. Это связано с тем, что применение антибактериальной терапии связано с некоторым снижением иммунной защиты, с развитием устойчивости к антибиотикам, что в период пандемии нежелательно.
Если Вы все-таки заболели COVID-19
Важно сообщить врачу, проводящему терапию COVID-19, об имеющемся у Вас хроническом заболевании, а также о принимаемых лекарственных препаратах.
Это позволит врачу выбрать наиболее безопасное для Вас лечение, избежать назначения лекарств, которые могут неблагоприятно взаимодействовать с постоянно принимаемыми Вами препаратами.
Если у Вас хроническое заболевание печени, при инфицировании COVID-19 следует избегать передозировки парацетамола (не более 2 грамм в сутки), а также минимизировать прием нестероидных противовоспалительных препаратов. Не отменять постоянно получаемое по поводу заболевания печени лечение, обсудить с лечащим врачом добавление препарата урсодезоксихолиевой кислоты для профилактики и лечения лекарственного повреждения печени.
Если у Вас аутоиммунное заболевание печени или кишечника, врачи рекомендуют продолжать постоянно принимаемую терапию, но прием таких препаратов как азатиоприн, метотрексат может быть временно приостановлен.
Если у Вас ГЭРБ, язвенная болезнь, то среди антисекреторных препаратов надо отдать предпочтение рабепразолу или пантопрозолу — более безопасным в плане риска лекарственных взаимодействий.
Важно избегать или минимизировать прием нестероидных противоспалительных препаратов.
Врачи в период заболевания COVID-19 для профилактики осложнений рекомендуют дополнительно принимать препараты, обладающие защитным действием на слизистую оболочку пищевода и желудка (ребамипид и др).
Последствия COVID-19 у больных с заболеваниями органами пищеварения
Перенесенная тяжелая инфекция может привести к обострению и декомпенсации хронического заболевания печени, особенно на стадии цирроза печени.
Редко наблюдается тяжелая реакция на применяемые препараты для лечения COVID-19 в виде лекарственного гепатита. Такое заболевание может развиться и у пациентов с прежде здоровой печенью.
Еще реже вирус и лекарства могут спровоцировать развитие впервые аутоиммунного заболевания печени.
Поэтому все пациенты, перенесшие COVID-19, должны контролировать биохимический анализ крови после разрешения инфекции и при сохранении отклонений в биохимических показателях обратиться к врачу-гепатологу.
Перенесенный COVID-19 и лекарственная нагрузка могут привести к обострению и осложнениям (например, кровотечение, диарея) других заболеваний органов пищеварения.
Прием антибактериальных препаратов может привести к нарушению микрофлоры кишечника с развитием послабления стула (так называемая антибиотик-индуцированная диарея). Такая диарея проходит самостоятельно и при применении лекарств — пробиотиков, адсорбентов.
Однако в ряде случаев при наличии особой бактерии (клостридии) в кишечнике может развиться тяжелая и опасная форма диареи, которая называется псевдомембранозный колит.
Поэтому во всех случаях развития после COVID-19 болей в животе, изжоги, тошноты, диареи и вздутия кишечника следует обратиться к врачу гастроэнтерологу и провести полное обследование для уточнения причины и проведения соответствующего лечения.
Аутоиммунные заболевания: важность верификации диагноза, успехи грамотного подбора лечения
«Существует два направления, по которым может развиваться патология иммунной системы:
- Иммунодефицит – неспособность одного или нескольких компонентов иммунной системы реагировать на патоген по защитному механизму
- Аутоиммунное заболевание – ошибочное реагирование на структуры организма-хозяина, или, можно сказать, утрата к ним иммунной толерантности
Традиционно аутоиммунные болезни считаются редкими и, согласно эпидемиологическим исследованиям, встречаются у 3-5% людей, при этом самыми распространенными из них являются хронический аутоиммунный тиреоидит (цель – щитовидная железа) и сахарный диабет 1-го типа. Существует приблизительно 100 различных аутоиммунных заболеваний, как локально поражающих орган-мишень (например, аутоиммунный гепатит), так и носящих системный характер с множественными поражениями (типичный вариант – системная красная волчанка). Описано однозначное повышение рисков развития аутоиммунных заболеваний при наличии таковых у родственников первой линии, а также у монозиготных близнецов. В целом практически все подобные болезни чаще встречаются у женщин (в соотношении от 1:1 до 10:1) , за исключением одного из воспалительных заболеваний кишечника – болезни Крона, которая распространена у мужчин примерно в 1,2 раза больше. Данные также меняются в зависимости от географического региона. Так, аутоиммунное заболевание центральной нервной системы – рассеянный склероз – в десятки раз чаще регистрируется в Азии, чем в Европе, а сахарный диабет 1-го типа наиболее распространен в США и практически не отмечается в Китае.
До настоящего времени причинный фактор возникновения аутоиммунных заболеваний известен лишь в единичных случаях.
Наиболее активно обсуждается роль кишечной микробиоты, инфекционных агентов, продуктов горения табака, лекарственных препаратов, гормонов, воздействия ультрафиолета, тяжелых металлов и коллагеновых/силиконовых имплантов.
Классическим примером является давно известный феномен молекулярной мимикрии (подражания антигенной структуре собственного компонента клетки) М-белка пиогенного стрептококка (частого возбудителя острого тонзиллита) и «человеческих» лизоганглиозида и миозина, в результате чего происходит появление кардиотоксичных Т-лимфоцитов.
На сегодняшний день, несмотря на то, что для большинства аутоиммунных заболеваний ключевой триггерный причинный фактор не установлен, мы знаем, за счет каких именно звеньев иммунной системы реализуется механизм прогрессирования атаки иммунитета против собственного организма (патогенез). В основном в этом процессе задействован не какой-то отдельно взятый компонент иммунной системы, а группа таких компонентов, причем для каждой конкретной болезни (или хотя бы «подкласса» болезней) механизм может отличаться. Этот аспект определяет исключительную значимость корректной верификации диагноза на максимально возможно раннем этапе. По крайней мере, необходимо понять, какой общий характер патогенеза лежит в основе совокупности симптомов пациента, и начать универсальное лечение, действующее на ключевые «точки» механизма заболевания.
Процесс подтверждения диагноза аутоиммунного заболевания в современных реалиях представляет собой оценку наличия у пациента комбинации клинических симптомов, лабораторных сдвигов (в том числе определение аутоиммунных антител различных типов), сопоставление их с данными морфологического исследования биопсийного материала (важнейший диагностический шаг при многих аутоиммунных клинических ситуациях) и с результатами проводимого пробного лечения, если таковое имело место. Далее происходит сопоставление этой комплексной информации с наборами диагностических критериев, которые разработаны экспертными сообществами практически для каждого заболевания, и если количество необходимых критериев набирается, это позволяет подтвердить (верифицировать) точный диагноз. Верификация диагноза, в свою очередь, уже делает возможным применение терапии, которая воздействует прицельно на некорректно функционирующие звенья иммунной системы.
В последние десятилетия, благодаря успехам фармакологии в лечении аутоиммунных заболеваний, без лишнего преувеличения можно утверждать о прорыве, связанном с появлением так называемых генно-инженерных биологических препаратов.
В отличие от традиционных синтетических лекарственных средств, такие препараты представляют собой биологические субстанции (в основном – тоже антитела), целью которых становится «точечное» блокирование именно тех компонентов иммунитета, которые наиболее задействованы в механизме развития того или иного заболевания.
Тем самым, во-первых, не происходит «выключения» сразу нескольких линий иммунной защиты и обеспечивается высокая эффективность лечения при значительно меньшей частоте специфических и неспецифических нежелательных явлений, хотя, безусловно, в виде нюансов они присутствуют и для таких лекарственных агентов.
Стоит также отметить, что в настоящее время генно-инженерная биологическая терапия с успехом используется и в онкологии, онкогематологии, аллергологии, кардиологии, и даже в лечении инфекционных заболеваний (здесь, собственно, следует упомянуть эффективные подходы к блокированию цитокинового шторма при тяжелом течении коронавирусной инфекции с помощью антител к интерлейкину-6 – одному из основных медиаторов иммунитета, запускающему системное воспаление).
Резюмируя, следует сказать, что аутоиммунные заболевания остаются одной из самых сложных областей медицины внутренних болезней, и работа с ними требует от врача исключительного внимания к индивидуальности каждого пациента, тщательного анализа и синтеза диагностической концепции, применения принципов доказательной медицины и глубоких фактических знаний, постоянно обновляемых терапевтических подходов к лечению таких болезней».
Основные системные и «локализованные» аутоиммунные заболевания
- Сосуды и система крови: локальные лейкоцитокластические васкулиты, идиопатическая тромбоцитопеническая пурпура, антифосфолипидный синдром
- Кожа: псориаз, витилиго, пузырчатка
- Поджелудочная железа: сахарный диабет 1-го типа, аутоиммунный панкреатит
- Нервная система: острый рассеянный энцефаломиелит, острая и хроническая воспалительная демиелинизирующая полинейропатия, рассеянный склероз, миастении
- Щитовидная и паращитовидные железы: болезнь Грейвса, аутоиммунный гипопаратиреоз, аутоиммунный тиреоидит Хашимото
- Орган слуха: аутоиммунная болезнь внутреннего уха
- Сердце: ревматическая лихорадка
- Печень: аутоиммунный гепатит, первичный склерозирующий холангит, первичный билиарный холангит (первичный билиарный цирроз)
- Желудочно-кишечный тракт: язвенный колит, болезнь Крона, целиакия, аутоиммунный атрофический гастрит
- Надпочечники: болезнь Аддисона
- Репродуктивная система: аутоиммунный орхит и оофорит
- Соединительная ткань и суставы: ревматоидный артрит, системная красная волчанка, болезнь Шегрена, системная склеродермия, смешанные заболевания соединительной ткани, анкилозирующий спондилит, псориатический артрит, дермато- и полимиозит