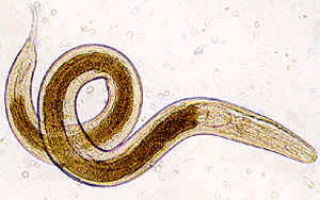
Медики из Аргентины установили, что рассеянный склероз протекает намного легче и развивается медленнее у пациентов, зараженных кишечными паразитами, в том числе аскаридами и острицами. По-видимому, выделяемые паразитами вещества подавляют активность некоторых типов клеток иммунной системы. В результате иммунная система человека перестает разрушать свои собственные нервные клетки.
Рассеянный склероз относится к числу аутоиммунных заболеваний. Это значит, что в основе болезни лежит ненормальное поведение иммунной системы, которая вместо того, чтобы оберегать нас от бактерий и вирусов, вдруг начинает нападать на собственные ткани и клетки организма.
Сегодня в мире наблюдается быстрый рост аутоиммунных заболеваний, причем наиболее остро эта проблема стоит в самых развитых и богатых странах. Причины этого не вполне понятны.
Согласно одной из наиболее обоснованных гипотез (так называемая «гигиеническая гипотеза»), распространение аллергий, рассеянного склероза и других аутоиммунных заболеваний является обратной стороной развития медицины и гигиены.
Разнообразные микробы и паразиты «обучают» иммунную систему и «настраивают» ее таким образом, чтобы она не путала свое и чужое и боролась с реальными, а не мнимыми опасностями.
Поскольку ни наши предки-приматы, ни сами люди вплоть до недавних пор отнюдь не страдали маниакальным стремлением всё вокруг себя стерилизовать и дезинфицировать, неудивительно, что в ходе эволюции наша иммунная система стала в определенном смысле зависимой от этих «учителей».
Недостаток реальных врагов может побуждать иммунную систему воевать с разного рода «ветряными мельницами». Кроме того, многие исконные паразиты человека могли выработать различные средства для подавления активности иммунной системы, а мы, эволюционируя параллельно со своими паразитами, приспосабливались к их хитростям и наращивали «боевую мощь» защитных систем организма.
«Гигиеническая гипотеза» была подтверждена опытами на лабораторных животных: оказалось, что некоторые паразиты действительно делают мышей и крыс менее подверженными аутоиммунным заболеваниям. Однако на людях это до сих пор не было показано.
Аргентинские медики в течение четырех с половиной лет наблюдали за 24 пациентами, страдающими рассеянным склерозом.
Половина этих людей была заражена различными кишечными гельминтами: у троих был обнаружен ленточный червь Hymenolepis nana, у троих — власоглав (Trichuris trichiura), у троих — аскарида (Ascaris lumbricoides), у двоих — угрица кишечная (Strongyloides stercoralis), у одного — острица (Enterobius vermicularis). Первый вид гельминтов относится к ленточным червям (Cestodes), остальные четыре — к круглым червям (Nematoda). Все 12 человек заразились гельминтами уже после того, как у них был обнаружен рассеянный склероз. Другие 12 пациентов не страдали гельминтозами. Обе группы пациентов были практически одинаковы по соотношению полов (по 8 женщин и 4 мужчины в каждой), возрасту и продолжительности заболевания (к моменту начала исследования все они страдали рассеянным склерозом от 6 до 8 лет).
В ходе наблюдения выяснилось, что у пациентов, не имеющих гельминтов, рассеянный склероз прогрессирует гораздо быстрее. У них за 4,5 года наблюдалось в общей сложности 56 обострений (relapses), в зараженной группе — только 3.
Серьезное ухудшение состояния (оцениваемое при помощи специального индекса EDSS — expanded disability status scale) в течение периода наблюдений произошло у всех незараженных и только у двух из двенадцати зараженных.
У всех незараженных также появились новые (или увеличились старые) очаги поражения (lesions) в мозге, выявляемые при помощи магнитно-резонансной томографии (всего 164 новых очага); у зараженных гельминтами появилось в общей сложности лишь 14 новых очагов, причем у шестерых пациентов из двенадцати не появилось ни одного нового очага.
Исследователи обнаружили, что у пациентов, зараженных гельминтами, в крови постоянно повышен уровень определенных типов белков и белых кровяных клеток, функция которых состоит в подавлении активности тех категорий Т-лимфоцитов, которые вносят основной вклад в развитие рассеянного склероза, то есть в разрушение миелиновых оболочек нейронов. Скорее всего, паразиты выделяют какие-то вещества, влияющие на деятельность определенных регуляторных блоков иммунной системы, в результате чего снижается активность некоторых разновидностей клеток-убийц. Это идет на пользу не только самому паразиту, но и нервной системе пациентов.
Ученые признают, что для окончательных выводов необходимы дополнительные исследования. Изученная выборка пациентов слишком мала, чтобы понять, какие именно гельминты наиболее полезны лицам, страдающим рассеянным склерозом.
Кроме того, конечно, медиков не очень вдохновляет перспектива лечить людей, заражая их аскаридами.
Чтобы разработать действительно перспективные методы лечения, необходимо выявить те вещества, при помощи которых паразиты регулируют работу иммунной системы человека.
Источник: J. Correale, M. Farez. Association between parasite infection and immune responses in multiple sclerosis // Annals of Neurology. 2007 (Published Online: 17 Jan 2007).
См. также:
Рассеянный склероз: роковая ошибка иммунной системы, «Элементы», 17.01.2006.
Александр Марков
- 3
- Показать комментарии (3)
- Свернуть комментарии (3)
- Может быть, просто тратится ресурс иммунной системы? Ну как если человек рисует квадрат левой рукой, то ему трудно одновременно нарисовать круг правой, что в отдельности он выполняет великолепно. Ответить
- По-видимому, механизм все-таки сложнее, т.к. авторы обнаружили у пациентов с глистами повышенное содержание в крови ряда регуляторных белков и разновидностей лимфоцитов, обладающих супрессорной функцией. Т.е. не просто не хватает ресурсов иммунной системы на борьбу и с глистами и с собственным мозгом, а происходит активное подавление активности определенных категорий Т-лимфоцитов. Ответить
- Можно предложить и другую непротиворечивую гипотезу: инфекция, вызывающая РС, препятствует заражению гельминтами. Причем, это легко проверить. Ответить
Написать комментарий
Черви-паразиты помогли вылечить повторный рассеянный склероз
ТАСС, 15 июня. Британские и румынские биологи успешно защитили несколько десятков добровольцев от повторного появления рассеянного склероза с помощью круглых червей-паразитов. Результаты клинических испытаний опубликовал научный журнал JAMA Neurology.
«Мы провели пока самое большое исследование по использованию круглых червей для лечения рассеянного склероза. Мы не только показали, что подобная терапия работает и что она безопасна для пациентов, но и узнали несколько особенностей работы иммунитета, которые помогут воспроизвести этот эффект другими путями», – пишут исследователи.
Рассеянный склероз – это аутоиммунная болезнь нервной системы, при развитии которой иммунные клетки начинают атаковать оболочку нервных волокон, так называемый миелин. В результате нервы начинают хуже проводить сигнал и «замыкать». Сначала из-за этого происходит легкое онемение конечностей, а при прогрессировании болезни может вызвать паралич, слепоту и смерть.
Согласно статистике Всемирной организации здравоохранения (ВОЗ) от рассеянного склероза в мире сейчас страдает около 2,3 млн. При этом в мире нет лекарств, которые могли бы полностью подавить эту болезнь.
Группа британских и румынских исследователей под руководством профессора иммунологии из Ноттингемского университета (Великобритания) Дэвида Притчарда добилась существенного прогресса в этом направлении. При этом они использовали довольно необычное «лекарство» – круглых паразитических червей вида Necator americanus.
Природный регулятор иммунитета
Ученые достаточно давно заметили, что если носители рассеянного склероза и других аутоиммунных болезней заражены паразитическими червями, то болезнь у них проходит гораздо легче, чем у остальных пациентов.
Врачи и биологи из самых разных стран мира сейчас проводят сразу несколько клинических испытаний по лечению этой болезни с помощью разных паразитов, в том числе нематод вида Trichuris ovis, которые поражают овец.
Притчард и его коллеги выбрали для подобных опытов другой вид круглых червей – Necator americanus. Они основывались на том, что этот вид паразитирует только на человеке, и поэтому полностью совместим с его жизнедеятельностью.
Как правило, заражение этими нематодами крайне редко вызывает малокровие и другие тяжелые последствия, но при этом их присутствие в кишечнике человека значительно снижает количество воспалений и «перепрограммирует» иммунную систему на уменьшение ее аутоиммунной активности.
Подтвердив безопасность Necator americanus в опытах на здоровых добровольцах, британские и румынские биологи несколько лет назад начали вторую фазу клинических испытаний.
В них участвовали 73 жителя Англии, которые страдали от повторного появления рассеянного склероза.
Во время этих опытов ни сами ученые, ни добровольцы не знали, принимали ли они настоящие яйца нематод или же проглатывали пустышки, не ведущие к появлению паразитов в их кишечнике.
Наблюдения в течение следующих девяти месяцев показали, что у участников исследования с червями в кишечнике крупных повреждений миелиновой оболочки нейронов оказалось гораздо меньше, чем у добровольцев без паразитов. Более того, у половины пациентов, которых заразили Necator americanus, не появилось ни одного нового приступа болезни. Среди участников контрольной группы это произошло лишь у 28% человек.
Эти позитивные изменения биологи связывают с тем, что из-за появления паразитов в кишечнике в организме участников исследования поменялось количество разных типов лимфоцитов и эозинофилов – противопаразитной разновидности клеток иммунной системы. В частности, у всех добровольцев с нематодами эозинофилов стало больше, тогда как у участников контрольной группы количество этих клеток к концу эксперимента значительно упало.
Подобные процессы, как предполагают ученые, можно воспроизвести и без участия червей-паразитов. Благодаря этому можно будет создать лекарства, которые смогут подавлять чрезмерно высокую активность иммунитета как у носителей рассеянного склероза, так и других болезней, заключают авторы статьи.
«Кесимпта»: новое высокоэффективное лекарство от рассеянного склероза | МОСМЕДПРЕПАРАТЫ
- «Кесимпта» (Kesimpta, офатумумаб) — новый лекарственный препарат, предназначенный для терапии взрослых пациентов с редицивирующими формами рассеянного склероза, включая клинически изолированный синдром (CIS), рецидивирующе-ремиттирующий рассеянный склероз (RRMS), вторично-прогрессирующий рассеянный склероз (SPMS) в активной форме.
- «Кесимпта», предложенный «Новартис» (Novartis), одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в августе 2020 года.
- Маркетинговое разрешение Европейского агентства по лекарственным средствам (EMA) получено в марте 2021 года: «Кесимпта» предназначен для терапии взрослых пациентов с рецидивирующими формами рассеянного склероза с активным заболеванием согласно клиническому течению и МРТ-изображениям.
«Кесимпта» — препарат, изменяющий течение рассеянного склероза (ПИТРС), и прямой конкурент «Окревуса» (Ocrevus, окрелизумаб), бестселлера «Рош» (Roche). Основное отличие офатумумаба от окрелизумаба состоит в способе и схеме применения.
Если «Окревус» назначается в стационарных условиях внутривенными инфузиями (каждые 6 месяцев — после двух нагрузочных доз с промежутком в 2 недели между ними), то «Кесимпта» вводится в домашних условиях самим пациентом подкожными инъекциями (каждые 4 недели — после трех нагрузочных доз с промежутком в 1 неделю между ними). Кроме того, вливание «Окревуса» требует определенной премедикации, включающей кортикостероид, антигистаминный и жаропонижающий препараты.
Существует множество непреложных свидетельств о существенном вкладе B-клеток как в регуляцию нормального аутоиммунитета, так и в патогенез иммуноопосредованных заболеваний, включая рассеянный склероз.
В случае последнего профиль B-клеток смещен в сторону провоспалительного фенотипа, притом что они содействуют прогрессированию рассеянного склероза посредством ряда механизмов, как то: продуцирование антител, презентация антигенов, стимуляция и активация T-клеток, побуждение аутопролиферации направляющихся в головной мозг аутореактивных CD4+ T-клеток, выработка провоспалительных цитокинов, а также формирование эктопических менингеальных герминативных центров, управляющих корковой патологией и способствующих неврологической инвалидизации.
Офатумумаб (ofatumumab) — полностью человеческое моноклональное антитело против поверхностного антигена CD20, который экспрессирует на B-клетках на всех стадиях их развития (кроме первой и последней), при этом уровень его экспрессии постепенно нарастает по мере созревания B-клеток.
Офатумумаб связывается с CD20, тем самым активируя иммунную систему, осуществляющую лизис B-клеток, — путем комплементозависимой цитотоксичности (CDC), антителозависимой клеточноопосредованной цитотоксичности (ADCC) и фагоцитоза.
Результирующее истощение пула B-клеток оказывает должный терапевтический эффект при рассеянном склерозе.
Следует понимать, что офатумумаб — вовсе не новое лекарственное средство: швейцарский фармгигант коммерциализировал «Арзерра» (Arzerra, офатумумаб) еще в октябре 2009 года, когда было получено разрешение FDA на его применение в терапии хронического лимфоцитарного лейкоза. В январе 2018 года «Новартис» изъяла «Арзерра» из продажи всех стран за исключением США, посчитав спрос на него недостаточным ввиду сильного давления со стороны других куда более эффективных лекарственных средств против хронического лимфолейкоза.
Определенная параллель между офатумумабом и окрелизумабом очевидна: препарат авторства «Рош» является модифицированной версией «Ритуксана»/«Мабтеры» (Rituxan/MabThera, ритуксимаб), который дозволен в терапии хронического лимфоцитарного лейкоза, неходжкинских лимфом и ряда аутоиммунных патологий, и который до дебюта «Окревуса» вовсю применялся вне инструкции при рассеянном склерозе.
«Новартис» получила права на офатумумаб против онкологических заболеваний в ходе сложного обмена активами с «ГлаксоСмитКляйн» (GlaxoSmithKline) в 2014 году. Первая за 16 млрд долларов купила у второй онкологический бизнес и за за 7,1 млрд долларов продала ей портфель вакцин (кроме противогриппозных); безрецептурная деятельность предприятий была объединена.
Позже фармгигант из Базеля выкупил права на все другие потенциальные показания применимости офатумумаба: за 1,034 млрд долларов плюс 12-процентное роялти от реализации препарата в терапии аутоиммунных заболеваний. «Новартис» также будет отдавать 10-процентное роялти датской «Дженмаб» (Genmab), оригинатору офатумумаба.
Эффективность офатумумаба в лечении рецидивирующих форм рассеянного склероза (RMS) была изучена в двух идентичных клинических испытаниях ASCLEPIOS I (NCT02792218) и ASCLEPIOS II (NCT02792231) фазы III (рандомизированных, двойных слепых, многоцентровых, международных) среди взрослых (18–55 лет) пациентов (n=1881) с рецидивирующе-ремиттирующим рассеянным склерозом или вторично-прогрессирующим рассеянным склерозом в активной форме.
Среди основных требований к участникам: либо как минимум один рецидив в предшествовавшем году, либо хотя бы два рецидива за минувших пару лет, либо наличие очагов воспаления головного мозга на T1-взвешенных МРТ-изображениях с контрастированием гадолинием в предшествовавшем году; балл по расширенной шкале степени инвалидизации (EDSS) в пределах 0–5,5.
Сравнение проводилось с пероральным «Абаджио» (Aubagio, терифлуномид), ПИТРС авторства «Санофи» (Sanofi). Максимальная продолжительность исследований — 30 месяцев.
В обоих исследованиях группы офатумумаба вышли к первичной конечной точке, продемонстрировав статистически и клинически значимое уменьшение частоты рецидивов в пересчете на год (ARR): до 0,11 и 0,10 — против 0,22 и 0,25 в группах терифлуномида. Относительное снижение ARR составило 50,5% (отношение рисков [HR] 0,495 [95% ДИ: 0,374–0,654]; p
Гилениа: новые возможности в лечении рассеянного склероза
Раздел только для специалистов в сфере медицины, фармации и здравоохранения!
Авторы: И.Д.СТОЛЯРОВ, д.м.н., профессор, А.М.ПЕТРОВ, к.м.н., М.В.ВОТИНЦЕВА, к.м.н., Е.В.ИВАШКОВА, Институт мозга человека им. Н.П.Бехтеревой РАН, С.-Петербург
Диагноз РС основывается на клинических характеристиках проявления патологического процесса в центральной нервной системе (ЦНС).
Оценка повреждения ЦНС при РС проводится с применением как клинических неврологических, так и радиологических (нейровизуализационных – магнитно-резонансная томография (МРТ), позитронно-эмиссионная томография (ПЭТ)) и иммунологических методов.
Стремление изменить течение заболевания и улучшение понимания патогенеза РС привели к созданию парентеральных и таблетированных иммуномодулирующих и иммуносупрессивных препаратов, изменяющих течение РС (ПИТРС).
Дальнейшее изучение развития структурных и функциональных изменений ЦНС на разных этапах заболевания может способствовать разработке новых методов восстановления утраченных функций и определения прогноза заболевания.
Рассеянный склероз (РС) – тяжелое хроническое заболевание головного и спинного мозга, поражающее сравнительно молодых людей 20–40 лет. В последние годы отмечается неуклонная тенденция не только к росту заболеваемости РС, но и к омоложению контингента больных. В настоящее время изучение РС является одной из актуальных задач современной медицины, что обусловлено неясностью многих вопросов возникновения и механизмов развития заболевания, трудностями диагностики на ранних стадиях развития, разнообразием клинических вариантов течения, быстрой инвалидизацией, отсутствием эффективных методов лечения[4]. Положение об активном проникновении через гематоэнцефалический барьер (ГЭБ) в ткань мозга CD4+ и СD8+ Т-лимфоцитов, потенциально аутоагрессивных к антигенам миелина, которые начинают локально пролиферировать, привлекать другие клетки крови и запускать эффекторные реакции, повреждающие миелин и аксон, является основной гипотезой иммунопатогенеза РС [2]. Диагноз РС в первую очередь основывается на клинических характеристиках проявления патологического процесса в центральной нервной системе (ЦНС). Оценка повреждения ЦНС при РС проводится с применением как клинических неврологических, так и радиологических (нейровизуализационных – магнитно-резонансная томография (МРТ), позитронно-эмиссионная томография (ПЭТ)) и иммунологических методов. Данный подход позволяет одновременно оценивать как системные аутоиммунные нарушения при РС, так и локальные функциональные и морфологические изменения в ЦНС. Комплексное клиническое, инструментальное, нейроиммунологическое исследование пациентов с различными типами течения РС позволяет определить, насколько значимы поражения коры и подкорковых структур в механизмах развития этого заболевания, а также способствует совершенствованию диагностической и терапевтической тактики при РС.
В последние годы отмечается неуклонная тенденция не только к росту заболеваемости РС, но и к омоложению контингента больных.
Высокоэффективный центр диагностики и лечения РС, включающий в себя амбулаторную службу, радиологическую службу (МРТ, ПЭТ, компьютерная томография (КТ)) и стационар, создан в Институте мозга человека им. Н.П.Бехтеревой РАН (ИМЧ РАН, С.-Петербург). На базе института осуществляется диагностика и мониторинг терапии у сотен больных с РС из С.-Петербурга, северо-запада и других регионов РФ. В центре РС ИМЧ РАН накоплен значительный опыт исследования Гилениа, подготовлена программа дальнейшего изучения действия препарата с использованием современных методов нейровизуализации. Для изучения изменений функционального состояния ЦНС применяют функциональную МРТ (фМРТ) и ПЭТ. Использование современных МРТ-техник показало наличие ультраструктурных нарушений в «неизмененных» регионах ЦНС. Функциональная МРТ и ПЭТ продемонстрировали наличие функциональных перестроек в головном мозге, развивающихся в ответ на повреждение тканей [3, 4]. Дальнейшее изучение развития структурных и функциональных изменений ЦНС на разных этапах заболевания может способствовать разработке новых методов восстановления утраченных функций и определения прогноза заболевания.
Стремление изменить течение заболевания и улучшение понимания патогенеза РС привели к созданию парентеральных и таблетированных иммуномодулирующих и иммуносупрессивных препаратов, изменяющих течение РС (ПИТРС): β-интерферонов, глатирамера ацетата, митоксантрона, Гилениа, натализумаба, достоверно снижающих частоту обострений и замедляющих нарастание инвалидизации, влияющих на активность иммунопатологического процесса по данным МРТ.
Лечение РС является одной из наиболее актуальных и сложных проблем современной неврологии. К сожалению, существующие препараты могут лишь снизить частоту и тяжесть обострений, а также замедлить темпы накопления неврологического дефицита, что подтверждается позитивной динамикой по данным МРТ головного и спинного мозга [1, 8, 9, 10]. В связи с этим одной из ключевых проблем лечения РС является создание и клиническое исследование новых препаратов, блокирующих развитие атрофии головного мозга, воспаления и демиелинизации, снижающих частоту обострений, предотвращающих прогрессирование инвалидизации.
Существует объективная потребность в безопасных и эффективных пероральных препаратах для лечения РС.
Интерферон бета-1b и глатирамера ацетат являются биологическими препаратами для подкожного введения, требующими регулярных инъекций, что вызывает развитие побочных эффектов (включая реакции в месте инъекции).
Парентеральное введение лекарственных средств в течение длительного периода вызывает снижение приверженности больных к лечению [7].
Таким образом, существует объективная потребность в безопасных и эффективных пероральных препаратах для лечения РС. Использование нового высокоэффективного неинъекционного препарата для лечения РС позволит повысить приверженность и общую удовлетворенность процессом лечения.
В настоящее время имеется длительный опыт использования пациентами препарата Гилениа (финголимода) – более 6 лет в ряде крупных клинических исследований.
В ходе основных исследований финголимода III фазы TRANSFORMS и FREEDOMS (при участии ИМЧ РАН) было продемонстрировано, что препарат в дозе 0,5 мг/сут высокоэффективен для лечения ремиттирующего РС.
По данным однолетнего исследования TRANSFORMS, в сравнении с существующей терапией первой линии – ИФН β-1а в/м происходило значительное снижение годовой частоты рецидивов и частоты возникновения новых МРТ-очагов (против ИФН β-1а в/м).
По данным двухлетнего плацебо-контролируемого исследования FREEDOMS, происходило значительное снижение годовой частоты рецидивов, частоты новых МРТ-очагов и риска прогрессирования инвалидности. Доза 0,5 мг/сут является оптимальной по безопасности и переносимости.
Опыт применения в исследованиях II и III фазы составил более 5 300 пациенто-лет у более 3 000 пациентов с РС [10].
На конгрессе Европейского комитета по лечению и исследованию рассеянного склероза (ECTRIMS) в октябре 2010 г. был проведен подробный анализ данных о финголимоде [5].
Шестилетний опыт применения финголимода позволил подробно изучить профиль безопасности финголимода и его хорошую переносимость.
Под руководством П.Соренсена (Дания) и Л.Каппоса (Швейцария) прошел сателлитный симпозиум Novartis Pharma «Рассеянный склероз – опыт использования и значение финголимода для лечения РС». В выступлении Соренсена были проанализированы вопросы распространения и роли сфингозин-1-фосфатных рецепторов и возможность их модуляции. В выступлении Ф.Баркофа (Нидерланды) описан значительный эффект финголимода, связанный с замедлением атрофии головного мозга у больных РС. Л.Каппос, опираясь на результаты клинических исследований TRANSFORMS и FREEDOMS, показал высокую эффективность нового перорального препарата, превышающую эффективность ранее созданных препаратов. По словам Каппоса, шестилетний опыт применения финголимода позволил подробно изучить профиль безопасности финголимода и его хорошую переносимость. В связи с успешными результатами клинических исследований финголимод зарегистрирован в России, США, странах Европейского союза. Финголимод выпускается компанией Novartis Pharma (Швейцария) в виде капсул по 0,5 мг и относится к группе иммуномодуляторов. Механизм действия препарата заключается в модулировании рецепторов сфингозин-1-фосфата (S1Р-рецепторов). Финголимод метаболизируется сфингозинкиназой до активного метаболита финголимода фосфата. В низких наномолярных концентрациях финголимода фосфат связывается с S1Р-рецепторами лимфоцитов 1, 3 и 4-го типов и быстро проникает в ЦНС через гематоэнцефалический барьер, связываясь с S1P-рецепторами нервных клеток 1, 3 и 5-го типов. Связывая S1Р-рецепторы лимфоцитов, финголимода фосфат блокирует способность лимфоцитов покидать лимфатические узлы, что приводит к перераспределению лимфоцитов в организме. Следует отметить, что при этом не происходит уменьшения общего количества лимфоцитов в организме. Перераспределение лимфоцитов приводит к снижению лимфоцитарной инфильтрации ЦНС, уменьшению выраженности воспаления и степени повреждения нервной ткани. При назначении пациентами с ремиттирующим РС (средний балл по шкале инвалидности, EDSS, 2.0) финголимода в дозе 0,5 мг частота клинических обострений болезни снижалась на 54%. При приеме препарата у 70% отмечалась стабильная ремиссия в течение 2 лет (по сравнению с 45,6% в группе плацебо). Финголимод достоверно снижал риск прогрессирования нетрудоспособности. При применении препарата достоверно увеличивалось время до наступления 3- и 6-месячного периода подтвержденного прогрессирования нетрудоспособности (оцениваемого как повышение оценки по шкале EDSS от исходных показателей) по сравнению с плацебо. Результаты МРТ головного мозга больных ремиттирующим РС на фоне лечения финголимодом подтверждают значительное снижение активности течения заболевания (интенсивности воспалительного процесса в ЦНС, размеров и количества очагов демиелинизации). Противопоказаниями к назначению препарата являются гиперчувствительность к финголимоду или любому другому компоненту препарата, беременность и период грудного вскармливания. Эффективность и безопасность применения препарата Гилениа у детей и подростков в возрасте до 18 лет не установлены. Препарат следует с осторожностью назначать пациентам старше 65 лет (ограниченное количество данных по применению), с тяжелыми нарушениями функции печени (более 9 баллов по шкале Чайлд – Пью), с сахарным диабетом (риск развития макулярного отека), а также при наличии в анамнезе увеита.
Безопасность терапии препаратом у пациентов с патологической брадикардией, обусловленной АВ-блокадой II и III степени (текущей или в анамнезе), или с синдромом слабости синусового узла не изучалась, поэтому данной категории больных Гилениа следует назначать только в случае, если польза от лечения превышает потенциальный риск (возможность развития тяжелых аритмий), обеспечив тщательный контроль за состоянием пациентов. Требуется соблюдать осторожность при назначении препарата пациентам с низкой частотой сердечных сокращений (ЧСС) в покое, менее 55 уд/мин (низкая частота ЧСС, не связанная с нарушениями функции сердца), а также при одновременном применении β-адреноблокаторов.
Возможен риск отрицательного влияния препарата на плод в период беременности, поэтому Гилениа можно применять во время беременности только в том случае, если предполагаемая польза для матери превышает потенциальный риск для плода. При применении препарата в экспериментальных исследованиях была выявлена репродуктивная токсичность, включавшая гибель плода и пороки развития органов, особенно незаращение артериального протока и дефекты межжелудочковой перегородки. Помимо этого рецепторы сфингозин-1-фосфата, на которые воздействует финголимод, вовлечены в процесс формирования сосудов во время эмбриогенеза. В настоящее время неизвестно о влияние финголимода на формирование сердечно-сосудистой системы у человека и имеются очень ограниченные данные по применению препарата у беременных женщин. В клинических исследованиях сообщалось о 20 случаях беременности у пациенток, получавших финголимод, но эти данные недостаточны для оценки безопасности применения Гилениа у данной категории больных. Данных о влиянии финголимода на сократительную деятельность матки и роды нет.
В экспериментальных исследованиях у животных, получавших препарат, отмечалось выделение препарата с молоком.
Учитывая теоретическую возможность развития нежелательных реакций у младенцев, находящихся на грудном вскармливании, необходимо прекратить кормление грудью или отменить препарат.
Рекомендуемая доза препарата – одна капсула по 0,5 мг внутрь 1 раз в сутки вне зависимости от времени приема пищи. В случае пропуска приема на следующий день Гилениа применяют в обычное время. Препарат предназначен для длительного лечения.
- Для подтверждения хорошей переносимости препарата пациентам с атриовентрикулярной блокадой высокой степени или синдромом слабости синусового узла, с низкой частотой сердечных сокращений (< 55 уд/мин) в покое или при одновременном приеме β-адреноблокаторов необходимо обеспечить наблюдение в течение 6 часов после начала лечения.
- Пациентов, ранее получавших лечение β-интерфероном и глатирамера ацетатом, при хорошей переносимости (отсутствие нейтропении) можно перевести на лечение препаратом Гилениа.
- Литература
- Рисунок — в приложении
Не требуется корректировать дозу препарата в зависимости от расы и пола пациента, у пациентов с нарушениями функции почек, а также у больных с легкими и умеренными нарушениями функции печени. Побочные действия препарата подробно изложены в инструкции к нему. В клинических исследованиях финголимода у пациентов с ремиттирующим РС получены следующие данные, касающиеся его профиля безопасности [6, 10]: — общая частота нежелательных явлений, требующих отмены лечения, и частота серьезных нежелательных явлений (СНЯ) у пациентов, получавших финголимод по 0,5 мг, были сходными с таковыми на плацебо; — нежелательных явлений, связанных с длительным применением препарата, выявлено не было; — в целом профиль нежелательных явлений, возникающих у пациентов с РРС, получающих финголимод, не зависит от пола и возраста пациентов, а также от того, получали они в прошлом средства базисной терапии РРС или нет. Единственным исключением служит повышение активности печеночных ферментов, которое у мужчин, получавших финголимод, отмечалось заметно чаще, чем у женщин. При прекращении приема препарата необходимо учитывать, что через 1–2 месяца после последнего применения Гилениа происходит нормализация количества лимфоцитов. Следует соблюдать осторожность при применении иммунодепрессантов вскоре после прекращения лечения препаратом, т.к. при назначении иммунодепрессантов в течение 1–2 месяцев после прекращения приема Гилениа возможно дополнительное угнетающее действие на иммунную систему. Использование высокоэффективного перорального иммуномодулирующего препарата для лечения ремиттирующего РС позволяет значительно расширить возможности патогенетической терапии РС и повысить ее эффективность. 1. Бойко А.Н., Столяров И.Д., Сидоренко Т.В. и соавт. Патогенетическое лечение рассеянного склероза: настоящее и будущее. Журн. неврологии и психиатрии им. С.С.Корсакова 2009; 109 (7, вып. 2): 90–99. 2. Гусев Е.И., Бойко А.Н. Рассеянный склероз: от изучения иммунопатогенеза к новым методам лечения. М: Из. ООО “Губернская медицина”, 2001. — 128 с. 3. Прахова Л.Н., Ильвес А.Г. Структурные и функциональные изменения головного мозга при рассеянном склерозе (механизмы развития, роль и методы оценки с использованием современных методов нейровизуализации). Неврологический журнал, 2009; 6: 19–23. 4. Рассеянный склероз: диагностика, лечение, специалисты. Под ред. И.Д.Столярова, А.Н.Бойко. СПб: ЭЛБИ-СПб., 2008. — 320 с. 5. Столяров И.Д., Вотинцева М.В. Рассеянный склероз: новое в диагностике и лечении (по материалам 26-го Конгресса Европейского комитета по лечению и исследованию РС). Нейроиммунология 2010; 8 (3–4): 64–66. 6. Cohen J.A. et al. Oral Fingolimod or Intramuscular Interferon for Relapsing Multiple Sclerosis. N Engl J Med 2010; 362: 402–415. 7. Goodin D.S., Frohman E.M., Garmany G.P. et al. Disease modifying therapies in multiple sclerosis: Subcommittee of the American Academy of Neurology and the MS Council for Clinical Practice Guidelines. Neurology 2002; 58: 169–78. 8. Jacobs L.D., Cookfair D.L., Rudick R.A. et al. Intramuscular interferon beta-1a for disease progression in relapsing multiple sclerosis. The Multiple Sclerosis Collaborative Research Group (MSCRG) Ann Neurol. 1996; 39(3): 285–94. 9. Johnson K.P, Brooks B.R., Cohen J.A. et al. Extended use of glatiramer acetate (Copaxone) is well tolerated and maintains its clinical effect on multiple sclerosis relapse rate and degree of disability. Copolymer 1 Multiple Sclerosis Study Group. Neurology 1998; 50: 701–708. 10. Kappos L. et al. A Placebo-controlled study of oral Fingolimod in relapsing MS. N Engl J Med 2010; 362: 387–401. 11. PRISMS Study Group. Randomized double-blind placebo-controlled study of interferon ?-1a in relapsing/remitting multiple sclerosis. Lancet 1998; 352: 1498–504.
Инновационные подходы к терапии вторично-прогрессирующего рассеянного склероза
Об одном из наиболее социально значимых заболеваний нервной системы, занимающем ведущее место (вместе с травмами и ревматологическими болезнями) в списке причин, ведущих к полной инвалидизации в молодом трудоспособном возрасте, и ставшем серьезным бременем для бюджета системы здравоохранения ряда стран, рассказала профессор кафедры неврологии, нейрохирургии и медицинской генетики РНИМУ им. Н.И. Пирогова, врач-невролог высшей категории межокружного отделения рассеянного склероза ГКБ № 24 (Москва) Наталья Хачанова.
— Совсем недавно РС считался редким заболеванием, а какова статистика по России сегодня?
— Уточню: редкие — это орфанные заболевания (менее 10 случаев на 100 тыс. населения), рассеянный склероз к этой категории не относится. В России его распространенность колеблется в диапазоне от 10 до 50 случаев на 100 тыс. населения.
По сравнению с другими неорфанными нозологиями пациентов с РС, конечно, заметно меньше, но их численность и в нашей стране, и в мире в последнее время неуклонно растет, что вызывает беспокойство у неврологов и у врачей других специальностей.
По данным выпускаемого Международной федерацией рассеянного склероза (Multiple Sclerosis International Federation, MSIF) «Атласа РС» (The Atlas of MS), в 2013 году в мире рассеянным склерозом страдали порядка 2,3 млн человек, с 2008 года глобальная распространенность РС выросла на 10% ‒ с 30 до 33 случаев на 100 тыс. населения. Сегодня количество больных РС достигло отметки в 2,8 млн. Рост, по мнению экспертов, связан как с улучшением диагностики и повышением возможностей патогенетической и симптоматической терапии, так и с истинным увеличением заболеваемости по «неясным пока причинам».
Данные по России несколько разнятся. Так, Минздрав сообщает о 85,2 тыс. человек с диагнозом РС в 2019 году (в 2017 – 80,5 тыс.). А в литературе, посвященной нашей проблематике, фигурируют иные сведения: более 100 тыс., ближе к 150 тыс. человек.
Не могу сказать, на чем основаны эти расчеты, наверное, исходя из 50 случаев на 100 тыс. населения. Возможно, эти различия связаны с тем, что фактически учет больных по конкретной нозологии мы начали вести сравнительно недавно.
Федеральный регистр больных РС постоянно обновляется, но, как считают большинство врачей и исследователей, он все же содержит неполные сведения.
Когда был введен регистр, ряду пациентов не были показаны дорогостоящие препараты, и, соответственно, по ним персонифицированные сведения в Минздрав не подавались.
Сейчас несколько иная ситуация: на любого впервые выявленного пациента подаются сведения (что, к слову, помимо всего прочего, объясняет статистический рост). Есть еще ряд больных, которых «упускает» реестр.
Например, люди, отказывающиеся от классической медицинской помощи, другие категории (военнослужащие), остающиеся вне сферы ведения специалистов, которые подают сведения.
— Неврологи говорят о РС как о мультифакториальном заболевании. Какое место среди этих факторов занимает генетика?
— Действительно, несколько составляющих складываются в пазл, и у конкретного пациента возникает заболевание. Среди факторов рассматривается и генетика, точнее, наследственная предрасположенность, наверное, не конкретно к рассеянному склерозу, а к возможному иммунологическому сбою. В нашей практике есть случаи семейного РС.
Среди «кусочков» этого пазла мы также рассматриваем факторы внешней среды, и здесь ‒ огромное поле для поиска. Это и дефицит витамина D, и низкая инсоляция, и курение, и отдельные факторы питания. Не исключается и роль вирусов, особенно частых инфекций в детском возрасте. Так или иначе, но мы говорим о совокупности факторов.
К этому следует добавить, что должен быть еще и некий пусковой элемент, триггер, который в итоге запускает весь механизм, провоцирующий иммунитет организма проявлять агрессию в отношении собственной нервной ткани.
Сейчас в качестве триггера интенсивно изучается группа герпес-вирусов, в частности вирус Эпштейна ‒ Барр. Это связано с тем, что больше 90% наших пациентов – носители этого вируса (многие в детском возрасте болели инфекционным мононуклеозом).
Возможно, пока рано говорить о нем как о хотя бы одном из этиологических факторов, но как о триггерном факторе ‒ однозначно есть основания.
— Насколько неврология продвинулась в ранней диагностике заболевания? С какими формами РС чаще всего сталкиваются врачи?
— Очень продвинулась.Но заметьте, не за счет использования новых методов. Они в принципе остались прежними: клинический осмотр и клиническая картина болезни, осмотр невролога и МРТ, исследование цереброспинальной жидкости. Поменялись сами критерии диагностики.
Теперь они позволяют устанавливать диагноз многим пациентам уже на момент дебюта заболевания, и самое главное ‒ благодаря лишь одному исследованию МРТ.
Хотя, конечно, некоторых пациентов приходится наблюдать в динамике, не ограничиваясь только одним исследованием (для людей с первично-прогрессирующим РС обязательно подтверждение).
— И тем не менее диагноз рассеянного склероза на самом деле непростой?
— РС считается «хамелеоном» неврологии. Под его маской могут скрываться совершенно разные заболевания. Поэтому мы должны дополнительно провести широкий дифференциальный поиск… Диагноз РС ставится в самую последнюю очередь. Но, повторю, в любом случае современные критерии позволяют поставить диагноз значительно быстрее.
Теперь по поводу форм РС. Порядка 10–15% пациентов на момент обращения будут иметь первично-прогрессирующий рассеянный склероз (ППРС), 85% и более ‒ ремиттирующую форму.
Но это если речь идет о дебютном больном.
Со временем картина по типу течения заболевания может отличаться: пациенты, которые изначально страдали ремиттирующим РС, могут перейти в группу вторично-прогрессирующего рассеянного склероза (ВПРС).
— ВПРС — неизбежный этап болезни?
— Да. Любой пациент, которому в дебюте поставили диагноз «ремиттирующий рассеянный склероз», рано или поздно столкнется с вторично-прогрессирующим течением. Это вопрос времени.
В ремиттирующей фазе у пациента эпизодически наблюдаются обострения, которые могут вести к временной инвалидизации. От обострения к обострению накапливается неврологический дефицит.
При переходе пациента в фазу ВПРС меняется сама концепция прогрессирования заболевания: обострений уже нет, но неврологический дефицит неуклонно нарастает.
Человек замечает, что стал проходить меньшие расстояния, ему чаще нужно останавливаться для отдыха… далее появляется необходимость приобретения вспомогательных средств ходьбы, затем ‒ инвалидного кресла. Но главное: для того чтобы заболевание прогрессировало, обострения уже не нужны, этот процесс протекает сам собой.
— А число обострений при РС можно предсказать?
— Нет, невозможно. Поэтому и существует терапия, задача которой предотвращать развитие обострений. И назначать ее следует как можно раньше.
Идеальный эффект от лечения ‒ отсутствие обострений, соответственно, нет неврологического дефицита и его прогрессирования.
Если МРТ не показывает новых очагов, болезнь заморожена на том этапе, на котором мы с ней столкнулись, то есть не повернули ее вспять, но остановили.
Есть международное наблюдение, указывающее на «естественное течение рассеянного склероза».
Из него следует, что с возрастом с длительностью болезни агрессивность иммунной системы начинает снижаться, поэтому даже у пациента без терапии частота обострений будет с годами снижаться.
Хотя в клинической практике мы чаще сталкиваемся с другой тенденцией: без специфического лечения темпы прогрессирования заболевания выше и путь до инвалидного кресла короче.
— Прогресс в лечении РС за последние несколько десятилетий ВОЗ признала одним из наивысших достижений современной медицины. Как изменилась терапия за это время?
— Изменения произошли колоссальные. Представьте, в 1996 году у нас был выбор всего из двух препаратов, в 2001-м к ним добавился еще один (два интерфероновых и один неинтерфероновый), а сегодня у нас линейка из 15 препаратов! Появилась возможность лечить пациента с любым типом течения РС, чего раньше не было. Плюс к этому постоянно разрабатываются новые молекулы.
Большим достижением России я считаю наличие программы «14 высокозатратных нозологий», обеспечивающей наших пациентов необходимыми ЛС. В нее входит значительная часть препаратов для лечения РС, а не вошедшие включены в Перечень ЖНВЛП. Таким образом, в любом случае наш пациент имеет право на бесплатное лекарственное обеспечение.
— Существуют ли отличия в тактике ведения пациентов с РС у нас и за рубежом?
—Нет. Во-первых, мы ориентируемся на лучший опыт зарубежных коллег, рекомендации Европейского комитета по исследованию и лечению рассеянного склероза и Европейской академии неврологии по лечению пациентов с рассеянным склерозом ‒ не изобретаем велосипед.
Во-вторых, инструкции к медицинскому применению лекарственного препарата обязательны на территории каждой страны.
Поэтому любые тактические изменения подходов в терапии ограничены этой инструкцией, и при нарушении ее положений фармацевтическая компания ‒ производитель лекарства снимает с себя ответственность за риски.
— Какие перспективы медикаментозной терапии у пациентов с ВПРС, есть ли лекарства, которые способствуют их поддержанию?
— Пациенты с ВПРС по современной классификации разделяются на четыре варианта. Это может быть пациент, у которого есть активность, то есть, несмотря на вторичное прогрессирование болезни, у него сохраняются обострения, но при этом прогресса инвалидности не происходит.
Второй вариант – при сохранении активности данные МРТ отмечают отрицательную динамику, появляются новые участки повреждения нервной ткани, из-за которых нарастает инвалидизация. Третий – когда у больного нет обострений, но состояние ухудшается.
И четвертый вариант — нет активности и нет прогрессирования, то есть РС перешел во вторичное прогрессирование, в какой-то момент накопил новый дефицит, а потом остановился.
Это международное разделение фенотипов на четыре варианта подразумевает: три первые группы (активность + прогрессирование; активность без прогрессирования; без активности, но с прогрессом) нуждаются в терапии, потому что болезнь протекает наглядно, ухудшает качество жизни пациента.
Для этих больных активная терапия, позволяющая бороться с обострениями, была и до конца прошлого года. А вот для пациентов, которые прогрессируют без активности, ЛС не было. Мы пробовали использовать один химиотерапевтический препарат, в какой-то степени он помогал, но был слишком токсичным, особенно при длительной терапии.
Новый зарегистрированный Минздравом России в 2020 году препарат решает эти проблемы.
Регистрационное исследование этого препарата показало, что он может быть использован у любого пациента с диагнозом «вторично-прогрессирующий рассеянный склероз». На мой взгляд, это расширяет наши возможности и несколько корректирует задачи: сейчас мы должны как можно раньше выявлять переход к ВПРС и менять лечебную тактику (если у пациента нет противопоказаний).
— От чего зависит успех терапии РС? Что можете посоветовать коллегам и их пациентам?
—Критерии успеха? Их, наверное, будет несколько. Прежде всего ‒ своевременность постановки диагноза. Потому что если больной 15 лет не обращался за помощью, то за эти годы неврологический дефицит будет совсем иным, нежели у пациента в начальной стадии заболевания.
В нашем случае своевременность диагностики тесно связана с активностью иммунной системы: чем ближе к дебюту мы находимся, тем выше иммунологическая агрессия.
Соответственно, тем больше возможностей как можно раньше эту агрессию задавить, не давая ей разрушать все больше значимых структур.
Чем позже мы ставим диагноз, тем больше вероятность того, что уже много процессов повреждения состоялось, а имеющейся терапией вспять ничего не повернуть.
Да и сама иммунная система может находиться уже не на той стадии, поэтому управляется менее эффективно. Важность своевременной диагностики трудно переоценить.
Очевидно, что определенная настороженность должна быть не только у пациента, но и у лечащего его терапевта, врача общей практики.
Далее… В течение первых лет, когда РС протекает наиболее агрессивно, следует быть предельно внимательными к пациентам (особенно ремиттирующим), к степени активности заболевания.
Тем более что современные терапевтические возможности позволяют это делать дифференцированно: для пациентов с высокой активностью есть линейка препаратов более агрессивного воздействия, более сильная, более эффективная.
Это очень важный период, не допускающий терапевтической инертности (когда врач не торопится применять лечебную тактику, изменять лечебный план).
Третий немаловажный фактор ‒ это доступность необходимых лекарственных препаратов. Мы должны научить пациента, как на Западе, разделять риски с врачом. Он должен занимать активную позицию в выборе лечения и, самое главное, в соблюдении рекомендаций. Увы, мы сплошь и рядом сталкиваемся с тем, что пациенты не понимают степень своей ответственности и участия в лечении.