- Клиническая характеристика
- Дистрофинопатии представляют собой группу Х‑сцепленных нервно‑мышечных заболеваний как с мягким, так и с тяжелым течением, развитие которых обсуловлено мутациями в гене DMD, кодирующем белок дисторфин.
- Тяжесть течения заболевания определяется типом мутации и функциональным доменом, в котором она локализуется.
Характеризуется бессимптомным повышением сывороточной креатинфосфокиназы и мышечными судорогами с миоглобинурией.
Проявляется развитием классических синдромов, включающих в себя прогрессирующую мышечную дистрофию Дюшенна (ПМДД), прогрессирующую мышечную дистрофию Беккера (ПМДБ) и DMD‑ассоциированную дилатационную кардиомиопатию.
Заболевание характеризуется прогрессирующей слабостью проксимальных мышц, вызванной дегенерацией мышечных волокон. Дегенерация возникает в результате нарушения устойчивости и эластичности мышечных волокон при сокращениях.
По мере развития заболевания мышечное волокно практически полностью разрушается и замещается соединительной тканью, что приводит к псевдогипертрофии мышц — увеличению их объема при утрате или значительном ослаблении функциональных возможностей.
МДД входит в перечень наиболее распространенных Х-сцепленных заболеваний [1].
Прогрессирующая мышечная дистрофия, как правило, начинает проявляться с повышенной утомляемости и слабости мышц нижних конечностей.
Дифференциальный диагноз
- Мышечная дистрофия поясно-конечностная (Limb-gridle muscular dystrophy) — ген FKRP
- Дистрофия Эмери-Дрейфуса (Emery-Dreifuss muscular dystrophy) — гены EMD, FHL1, LMNA
- Спинальная мышечная атрофия (spinal muscular atrophy) — ген SMN1
- Синдром Барта (Barth syndrome) — ген TAZ
Дистрофин
Расположение дистрофина и дистрофин-ассоциированных белков на мембране мышечного волокна.
Дистрофин является мембранным белком, а дистрофин-ассоциированный комплекс представляет собой наиболее важный элемент мышечного цитоскелета, который обеспечивает взаимодействие внутренних и внешних структур клетки, участвует в регуляции уровня кальция в мышце и передаче импульсов через мембрану мышечного волокна.
Дистрофин находится, главным образом, в мышечных клетках и некоторых нейронах. В норме в его функции входит обеспечение эластичности и устойчивости мышечного волокна при сокращении.
При отсутствии дистрофина мембрана клетки разрушается и, как следствие, мышечное волокно разрушается и замещается соединительной тканью, что приводит к значительному ослаблению функциональных возможностей.
79%от общего числа мутаций составляют крупные делеции и дупликации.
21%составляют небольшие изменения, включающие однонуклеотидные замены, небольшие вставки и делеции, а также мутации сайтов сплайсинга, причем миссенс‑варианты не характерны для ПМДД/Б [3].
Особенности клинических проявлений связывают с типом мутации в гене дистрофина:
Делеции в гене в большинстве случаев приводят к сдвигу рамки считывания и преждевременному окончанию считывания информации о построении белка, в результате дистрофин не образуется.
Структурные нарушения гена не нарушают рамку считывания, в результате образуется дефектный, функционально неполноценный белок.
Функционально активный дистрофин отсутствует в миокарде, но присутствует в скелетной мускулатуре, поскольку при данном типе дистрофинопатий патогенные варианты приводят к различным тканеспецифической транскрипции или альтернативному сплайсингу в сердечной мыщце и в скелетной [Ferlini et al 1999, Neri et al 2007].
Прогрессирующая мышечная дистрофия Дюшенна
Является более распространенной формой данного заболевания. Первые признаки появляются в раннем возрасте (1‑5 лет) и характеризуются задержкой моторного развития.
При начале ходьбы отмечаются частые падения, неловкость и утомляемость, трудности при подъеме по лестнице, беге и прыжках. Пациенты сохраняют способность к ходьбе до 10‑12 лет.
Кардиомиопатия развивается практически у всех пациентов с ПМДД после 18 лет.
Заболевание быстро прогрессирует и гибель, как правило, наступает до 30‑летнего возраста в результате респираторных осложнений и прогрессии дилатационной кардиомиопатии.
Прогрессирующая мышечная дистрофия Беккера
Как правило, характеризуется более поздней манифестацией и мягкими клиническими проявлениями. Клинические признаки начинают проявляться примерно в интервале от 10 до 20 лет. Заболевание прогрессирует достаточно медленно, в большинстве случаев, пациент утрачивает способность к передвижению без инвалидной коляски не ранее 40‑летнего возраста.
Не смотря на более мягкий нервно-мышечный фенотип, сердечная недостаточность является наиболее частой причиной смерти при ПМДБ (средний возраст смерти 40‑50 лет).
DMD-ассоциированная дилатационная кардиомиопатия
По данным источников, мутации в гене DMD могут стать причиной не только ПМДД/Б, но и дилатационой кардиомиопатии 3B [2,6], которая является заболеванием сердечной мышцы и приводит к дисфункции желудочков и, как следствие, сердечной недостаточности. Женщины, гетерозиготные по патогенному варианту находятся в группе высокого риска развития данной патологии.
1:5000новорожденных мальчиков
Прогрессирующая мышечная дистрофия Дюшенна [4]
1:20-25000
Прогрессирующая мышечная дистрофия Беккера [9]
Xp21.2–p21.1Ген дистрофина локализован на коротком плече Х хромосомы (Xp21.2-p21.1) и является одним из самых протяженных в человеческом геноме (более 2Mb, содержит 79 экзонов).
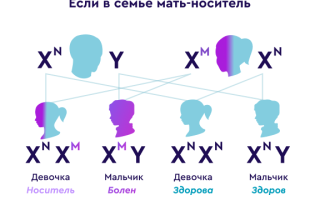
Дистрофинопатии по типу наследования являются Х-сцепленными рецессивными заболеваниями. Пенетрантность дистрофинопатий полная у гемизиготных мальчиков; у гетерозиготных девочек-носителей патогенного варианта она варьирует.
Если женщина является носительницей гетерозиготной патогенной мутации в гене DMD, вероятности передачи мутации:
При беременности мальчиком — 50%Мутация будет передана сыну и он будет болен ПМДД/Б.
Все мальчики, унаследовавшие от матери патогенный вариант, будут больны.
- При беременности девочкой — 50%Дочь унаследует данную мутацию и станет носительницей дефектной копии гена DMD.
- Девочки, унаследовавшие патогенный вариант могут быть как бессимптомными носителями патогенной мутации в гетерозиготном состоянии, так и иметь клинические проявления классической дистрофинопатии.
- Условия возникновения
При этом идентификация гетерозиготных носителей женского пола важна для клинического мониторинга кардиологических патологий у таких пациенток.
Больные ПМДД мужского пола, как правило, не успевают оставить потомство из-за ранней гибели; пациенты с ПМДБ и DMD-ассоциированной дилатационной кардиомиопатией могут иметь потомство: все их дочери будут гетерозиготными носителями патогенного варианта и ни один из сыновей не унаследует патогенный вариант.
- Выявление носительства мутации гена DMD и планирование семьи с учетом риска рождения больного ребенка — самый эффективный способ профилактики дистрофинопатий.
- Отец больного мальчика, как правило, не нуждается в молекулярно-генетическом тестировании, поскольку если он здоров, то он не может быть гемизиготным по патогенному варианту.
- Остаточный риск — это вероятность рождения мальчика с дистрофинопатией, даже если при исследовании гена DMD у матери носительства патогенного варианта в лейкоцитарной ДНК не обнаружено.
Существование остаточного риска обусловлено тем, что в 15-20% случаев развитие мышечной дистрофии происходит из-за мутации, возникшей de novo (наиболее вероятен гонадный мозаицизм) [5]. В таком случае все братья пробанда-мальчика также имеют повышенный риск унаследовать патогенный вариант и при последующих беременностях целесообразно проведение пренатальной диагностики.
Прогрессирующая мышечная дистрофия Дюшенна:
- Первые признаки проявляются в возрасте до 5 лет.
- Отмечается низкая активность ребёнка.
- Прогрессирующая симметричная мышечная слабость в проксимальных отделах.
- Частые падения, двигательная неловкость, быстрая утомляемость.
- Псевдогипертрофия мышц (увеличение объема при снижении функциональных возможностей), наиболее часто икроножных, может проявляться в форме ложного впечатления атлетического телосложения.
- Распространение патологического процесса носит восходящий характер. Первыми поражаются мышцы нижних конечностей, затем плечевого пояса, спины и проксимальных отделов верхних конечностей.
- На ранних стадиях снижаются сухожильные рефлексы.
- Примерно в возрасте 18 лет развивается кардиомиопатия [8], которая проявляется в виде гипертрофии левого желудочка и аритмии.
- Зависимость от инвалидной коляски развивается до 13 лет.
Прогрессирующая мышечная дистрофия Беккера:
- Дебют в возрасте от 10 до 20 лет с появления слабости и утомляемости мышц тазового пояса и ног.
- Ранними симптомами части становятся мышечные спазмы.
- Клинические проявления сходны с ПМДД, но выражены слабее.
- Прогрессирующая симметричная мышечная слабость в проксимальных отделах; слабость четырехглавой мышцы бедра иногда является единственным признаком развивающейся болезни.
- Зависимоть от инвалидной коляски развивается после 16 лет, хотя некоторые пациенты сохраняют самостоятельную двигательную активность в 30 и в редких случаях в 40 лет.
- В ряде случаев выявляются гипогенитализм и атрофия яичек [9].
DMD-ассоциированная дилатационная кардиомиопатия:
- Дилатационная кардиомиопатия с застойной сердечной недостаточностью, причем мужчины обычно манифестируют в возрасте от 20 до 40 лет, женщины — в более позднем возрасте.
- Как правило, клинические признаки поражения скелетных мышц отсутствуют.
- Быстрая прогрессия заболевания, приводящая к смерти в течение нескольких лет у мужчин и более медленное прогрессирование (десятилетия и более) у женщин.
Методы молекулярно-генетической диагностики
Подход к молекулярно-генетической диагностике дистрофинопатий заключается в последовательном проведении следующих этапов:
Поскольку большинство патогенных вариантов представляют собой делеции/дупликации одного и более экзонов, то целесообразно начать с анализа вариации числа копий (MLPA, хромосомный микроматричный анализ экзонного уровня). Если патогенный вариант не обнаружился, то следующим шагом проводится секвенирование гена DMD (с учетом протяженности гена, возможно начать поиск с «горячих точек»).
Поиск мутаций, которые характерны для нервно-мышечных заболеваний, в том числе со сходными клиническими проявлениями (см. Дифференциальный диагноз).
Полноэкзомное или полногеномное секвенирование может быть проведен в случае нетипичных клинических проявлений, с целью уточнения диагноза и установления возможных причинных находок в других генах.
Как правило, исследование проводится с учетом информации о ранее выявленных патогенных вариантах в гене DMD у членов семьи.
Биологические образцы, пригодные для проведения молекулярно-генетического исследования:
- Периферическая кровь (пробирка с ЭДТА)
- Околоплодные воды, взятые на 16 неделе беременности
- Ворсины хориона
- Пуповинная кровь (пробирка с ЭДТА)
Цитируемая литература:
1. Marina Basta, Ashish M. Pandya. Genetics, X-Linked Inheritance. Treasure Island. 2021 Jan; PMID: 32491315
2. https://www.omim.org/entry/302045
3. Hum Mutat. The TREAT-NMD DMD Global Database: Analysis of More than 7,000 Duchenne Muscular Dystrophy Mutations. Human Mutation. 2015 Apr; 36(4): 395–402.
4. Eppie M Yiu, Andrew J Kornberg. Duchenne muscular dystrophy. J Paediatr Child Health 2015 Aug; 51(8):759-64
5. «Метод молекулярно-генетического тестирования на носительство делеций и дубликаций экзонов гена DMD». Авторы: к.м.н., доцент Вильчук К.У., к.б.н. Гусина Н.Б., к.м.н. Гусина А.А., Мясников С.О., 2016.
6. Nakamura A. X-Linked Dilated Cardiomyopathy: A Cardiospecific Phenotype of Dystrophinopathy. Pharmaceuticals (Basel) 2015; 8:303–320.
7. Maria Sofia Falzarano, Chiara Scotton, Chiara Passarelli, Alessandra Ferlini. Duchenne Muscular Dystrophy: From Diagnosis to Therapy. Molecules. 2015 Oct 7; 20(10):18168-84.
8. Van Westering T.L.E., Betts C.A., Wood M.J.A. Current understanding of molecular pathology and treatment of cardiomyopathy in Duchenne Muscular Dystrophy. Molecules. 2015
9. Иванов В.И., Барышникова Н.В., Билева Д.С., Дадали Е.Л., Генетика. 2006
Многолетний опыт работы в области генетики, лабораторной диагностики и биоинформатики
Все данные строго конфиденциальны и не могут быть переданы третьим лицам
Особый контроль на каждом этапе проведения исследования
Результаты в короткие сроки
Доставка биоматериала по всей России
Если вам сложно ориентироваться в технической информации, переключитесь в режим для неспециалистовЯ не специалист
Механизмы развития хромосомных болезней — московский областной центр общественного здоровья и медицинской профилактики (моцозимп)
Наследственные болезни связаны с дефектами генетического аппарата, они часто встречаются в разных поколениях одной семьи, что указывает на передачу дефектной генетический информации. Но изменения в наследственном аппарате (мутация) могут также возникнуть при действии неблагоприятных факторов на плод во время беременности. Тогда у ребенка развивается заболевание, не встречавшееся ранее в семье, которое может теперь передаваться по наследству его детям.
Во многих случаях больной ребенок рождается у родителей – вполне здоровых носителей наследственной патологии – как результат случайной встречи двух измененных генов. Поэтому родителям такого ребенка важно уяснить: в болезни малыша не виноваты ни мать, ни отец, и взаимные обвинения неуместны и безосновательны.
Расширение наших знаний в области генетики привело к описанию новых генетических дефектов, которых уже сейчас известно более 5000.
Мы постоянно узнаем об ассоциации состояний, не считавшихся наследственными, с генетическими факторами и о многочисленных вариантах изученных генетических болезней.
Генетические дефекты выявляются у 10-15% детей, госпитализируемых в педиатрические клиники. Не будет преувеличением сказать, что 1-1,5% новорожденных появляется на свет с тем или иным генетическим дефектом.
Наследственный аппарат человека умещается на 46 хромосомах, образующих 22 пары соматических хромосом и две половые хромосомы (XX у женщин и XY у мужчин). Хромосомы расположены в ядре клетки, во время деления каждая из пары хромосом расходится по ядрам дочерних клеток, а затем, в каждой из хромосом «достраивается» копия.
Но при образовании яйцеклетки и сперматозоидов происходит так называемое «редукционное деление», при котором в половых клетках остается всего по 23 хромосомы. При слиянии яйцеклетки со сперматозоидом их наборы хромосом объединяются, так что новый организм получает те же 46 хромосом, поровну материнских и отцовских.
Яйцеклетка всегда имеет Х-хромосому, а сперматозоид – или X, или Y-хромосому (результат деления пары ХY у мужчины), поэтому пол ребенка зависит от того, какой сперматозоид оплодотворит яйцеклетку.
При редукционном делении в яйцеклетку и сперматозоид попадают хромосомы родителей, а те, в свою очередь получают их от двух бабушек и двух душек и т.д. Более того, во время редукционного деления одинаковые хромосомы могут обмениваться аналогичными участками. Именно поэтому дети одних родителей могут быть мало похожими друг на друга, но иметь сходство с теми или иными предками.
Хромосомы представляют собой двойные нити дезоксирибонуклеиновой кислоты (ДНК), закрученные в виде сложной спирали; они содержат нуклеотиды, пары которых соединяют две нити ДНК, причем аденин всегда связан с тимином, а цитозин с гуанином. Последовательность из 3 нуклеотидов (триплет) кодирует синтез определенной аминокислоты, входящей в состав белка. Информация о белках передается от хромосомы с помощью РНК (рибонуклеиновой кислоты) на клеточную структуру – рибосому на которой белок и собирается вне ядра клетки.
Ген – это участок хромосомы, на котором кодируется определенный белок, он содержит от сотен до миллионов нуклеотидов. Даже небольшие изменения гена ведут к возникновению дефектов в кодируемом белке.
Например, замена одного нуклеотида в гене, кодирующем один из белков гемоглобина, приводит к замене глютаминовой аминокислоты на валин, в результате чего возникает серповидноклеточная анемия – болезнь, часто встречающаяся у африканцев.
Иногда мутация гена приводит к полной остановке синтеза белка.
Часть генов находится вне ядра клетки – в митохондриях, энергетических ячейках клетки. Поскольку сперматозоиды эти гены не передают яйцеклетке, ребенок получает их только от матери. В настоящее время известно несколько наследственных заболеваний, возникновение которых связано с мутациями митохондриальной ДНК.
При неравномерном распределении хромосом в процессе редукционного деления в яйцеклетке или сперматозоиде их может оказаться больше или меньше 23, а у зародыша – меньше или больше 46.
Такие нарушения часто ведут к выкидышу; считается, что 25% всех выкидышей (около 5% всех зачатий) связаны с хромосомными нарушениями.
Ряд таких отклонений выявляется у детей с выраженной умственной отсталостью: добавочная 21-я хромосома выявляется при болезни Дауна, добавочные 13-я или 1 8-я хромосомы – при синдроме множественных пороков развития. При нехватке одной из хромосом возникают множественные дефекты развития.
С изменением числа половых хромосом связаны нарушения полового развития. Увеличение числа Х-хромосом (иногда до 5) при одной Y-хромосоме наблюдается (что наблюдается у новорожденных с частотой 1 : 750) проявляется отклонениями в половом и физическом развитии.
При увеличении числа Y-хромосом у мужчин (выявляется с частотой 1 : 1000) напротив, физическое развитие страдает мало, однако нередко наблюдаются отклонения в поведении и склонность к правонарушениям.
С частотой 1:3000 у женщин выявляется единственная Х-хромосома – при этом отсутствуют вторичные половые признаки.
Участок одной хромосомы может присоединяться к другой, так что в клетках ребенка оказывается избыток или недостаток наследственного материала.
И в этих случаях может развиться заболевание с умственной отсталостью: укорочение 4-й или 5-й хромосом обусловливает развитие синдрома «кошачьего крика» (назван так из-за характерного плача ребенка).
Хромосомы с возрастом родителей становятся более «ломкими», поэтому у пожилых родителей чаще рождаются дети с хромосомными заболеваниями.
Общая длина нитей ДНК во всех хромосомах одной клетки достигает одного метра, а общее число пар нуклеотидов оценивается в 6 миллиардов – вполне достаточно, чтобы закодировать индивидуальные особенности практически любого человека.
Моногенные и мультифакториальные болезни
Значительная часть наследственных болезней связана с изменением одного единственного гена («моно» – один). Один и тот же ген есть на обеих хромосомах.
Если один из пары генов -дефектный, мутант, то он может либо «доминировать» над здоровым геном (доминантный ген), либо не проявлять своих особенностей в присутствии здорового гена (рецессивный ген).
При наличии двух измененных генов в паре говорят о гомозиготном, при наличии мутации лишь в одном гене – о гетерозиготном состоянии.
При наличии у больного одного доминантного патологического гена у него будут выявляться признаки генетического заболевания. Поскольку ребенок такого больного получает от него лишь половину его генов, вероятность заболевания ребенка равна 50%. Это заболевание может повторяться в каждом поколении.
Такие заболевания обычно не угрожают жизни ребенка или же проявляются в зрелом возрасте; в противном случае больной не дал бы потомства, и передача гена прекратилась бы. К этим заболеваниям относятся, например хондродистрофия (резкое укорочение конечностей), поликистоз почек, нейрофиброматоз, полипоз кишечника, ряд болезней кожи, мышц и др.
Такие заболевания могут проявляться слабо в одном поколении и ярко _ в следующем.
При рецессивном типе наследование болезнь проявляется только при наличии двух мутантных генов (гомозиготность), тогда как при наличии одного мутантного и одного здорового гена (гетерозиготность) признаков болезни нет, хотя биохимические отклонения могут и присутствовать.
Естественно, что оба гена-мутанта ребенок мог получить только от родителей (по одному от каждого), являющихся здоровыми гетерозиготными носителями.
У таких родителей вероятность рождения больного ребенка составляет 25%, здорового – также 25%, а 50% детей этой пары имеют шанс стать здоровыми носителями патологического гена.
В отличие от доминантных заболеваний, рецессивные не повторяются в каждом поколении, поэтому отсутствие заболевания в семье не исключает возможности его появления в следующих поколениях.
Рецессивных болезней несколько тысяч, наиболее частой из них является муковисцидоз.
Другие патологические гены встречаются реже, однако в сумме получается, что каждый человек является носителем доброго десятка патологических генов! Наше счастье, что вероятность встречи супругов хотя бы с одним из этих генов очень мала, так что большинство (98-99%) детей рождаются свободными от наследственного заболевания.
При родственных браках вероятность встречи двух патологических генов резко повышается: при браке двоюродных брата и сестры риск рождения ребенка с рецессивным заболеванием повышается в 2 раза и достигает 5%. Об опасности таких браков было известно очень давно, и именно поэтому большинство религий возражает против заключения близкородственных браков.
Многие наследственные болезни не подчиняются описанным выше закономерностям. Они называются мультифакториальными. Их возникновение связано с влиянием нескольких (отсюда – «мульти») генов и других факторов.
- В целом, риск рождения больного ребенка в семье с мультифакториальным заболеванием редко превышает 5%.
- К мультифакториальным заболеваниям относятся: диабет, псориаз, аллергические заболевания, эпилепсия, шизофрения и другие болезни.
- Диагностика лечение и профилактика наследственных болезней
Если известна наследственная отягощенность в семье, выявить заболевание у одного из ее членов несложно, проведя необходимые исследования. Но постановка тысяч проб для выявления наследственных болезней у всех подряд невозможна.
Такой подход (скрининг) используют для диагностики некоторых наследственных болезней у новорожденных – это фенилкетонурия (нарушение обмена аминокислоты фенилаланина, влияющее на работу мозга) и врожденный гипотиреоз (снижение функции щитовидной железы).
Сейчас стали доступными методы исследования структур хромосом и многих генов, с помощью которых вполне возможно определить причину патологии у больного и выявить здоровых носителей патологического гена.
Это важно для генетического консультирования и проведения пренатальной (до рождения) диагностики наследственного заболевания у плода (по анализу фрагмента плодной оболочки или клеток, содержащихся в окружающей плод жидкости).
В настоящее время такие методы используются для диагностики более 100 наследственных заболеваний.
Что касается лечения наследственных болезней, то если под излечением понимать исправление нарушений в генетическом аппарате, то пока что это не удается, хотя такие исследования ведутся очень интенсивно. Но лечить многие болезни уже можно, и прежде всего – мультифакториальные.
Совершенствуется лечение и ряда моногенных болезней (муковисцидоз, фенилкетонурия, гемофилия, болезнь Гоше).
Однако большая часть наследственных болезней, к сожалению, пока не имеет эффективных методик лечения; перспективы связывают с развитием генной инженерии.
Большие успехи достигнуты в профилактике наследственных болезней.
До недавнего времени родителям, желающим иметь второго ребенка при наличии наследственной патологии у первенца, могли сообщить лишь о теоретическом риске повторного рождения больного ребенка, который при всех формах, кроме мультифакториальных, очень высок (25-50%).
Внедрение пренатальной диагностики открыло таким семьям перспективу рождения здорового ребенка. Если патологии нет, то мать рожает здорового ребенка, в случае выявления патологии беременность прерывают. Для профилактики хромосомных болезней такая диагностика рекомендуется всем беременным в возрасте 35 лет и старше.
Пройти диагностику и лечение инфекционного артрита в Москве
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначить только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Статья проверена врачом-ревматологом Филатовой Е.Е., носит общий информационный характер, не заменяет консультацию специалиста.Для рекомендаций по диагностике и лечению необходима консультация врача.
Инфекционный артрит — заболевание, которое вызывается различными возбудителями (вирусы, бактерии, грибы), попадающими непосредственно в ткани сустава.
Как правило, поражаются при этом суставы нижних конечностей — тазобедренные, коленные и голеностопные, несущие большую нагрузку.
Если заболевание не лечить, то оно может привести к серьезным последствиям, вплоть до разрушения суставного хряща.
Специалисты отделения ревматологии Клинического госпиталя на Яузе проводят тщательную диагностику и лечение инфекционных артритов, привлекая при необходимости других специалистов медицинского центра.
Симптомы инфекционного артрита
Проявления инфекционного артрита могут различаться, в зависимости от того, какой возбудитель стал причиной заболевания. Однако можно выделить ряд симптомов, общих для всех форм инфекционного артрита:
- сильная боль в суставе в покое или во время движения; сустав болезненный даже при прикосновении
- нарушение функции сустава, вынужденное положение конечности
- изменение контуров сустава
- отечность, покраснение и повышение температуры кожи в районе сустава
- общее плохое самочувствие, повышение температуры тела
- тошнота и рвота
- слабость, повышенное потоотделение
Если инфекционный артрит вызван гонококками, то могут быть и кожные проявления в виде высыпаний на коже и слизистых. Золотистый стафилококк является причиной такой формы артрита, при которой разрушение хрящей происходит очень быстро, буквально в течение 2-3 дней.
Причины и патогенез инфекционного артрита
Как правило, возбудитель артрита попадает в сустав с током крови или лимфы. В зависимости от того, какой именно возбудитель вызвал заболевание, различают бактериальный, вирусный, грибковый и паразитарный артриты.
Если возбудитель попадает в сустав извне, то такой артрит называется первичным. Если очаг воспаления находится в самом организме, то есть инфекция попадает из других органов и тканей, то артрит называется вторичным.
Также инфекционный артрит может развиться в результате травмы сустава и попадания возбудителей воспаления в рану. Посттравматические артриты выделяются в отдельную группу.
Заболевание может начаться у пациента в любом возрасте. В том числе известны случаи заболевания новорожденных. У детей чаще поражается несколько суставов (полиартрит), у взрослых — один.
Развитию инфекционного артрита способствуют следующие факторы:
- различные хронические артриты
- системные инфекционные заболевания
- системные заболевания соединительной ткани
- иммунодефицитные состояния (как правило, у пациентов, страдающих иммунодефицитом, развивается полиартрит)
- онкологические заболевания
- внутрисуставные инъекции или хирургические вмешательства на суставах, в ходе которых в ткани сустава может быть занесена инфекция
- сахарный диабет
- травмы
- наличие протезов суставов
- алкоголизм и наркомания (наркозависимые пациенты часто страдают поражением суставов осевого скелета)
- прием ряда препаратов, в том числе гормональных
При подозрении на развитие инфекционного артрита пациента направляют на рентген или УЗИ суставов. Также необходимо сделать анализ крови, иммунограмму, исследовать внутрисуставную жидкость, для анализа берутся мазки из половых путей. При подозрении на туберкулезную природу артрита проводится исследование для выявления очагов туберкулеза.
Острый инфекционный артрит лечится в стационаре. Пораженная конечность обездвиживается, затем постепенно наращивается объем движений. Если воспаление гнойное, то может быть проведена санация сустава (промывание).
В зависимости от возбудителя, подбирается препарат: антибиотики, противогрибковые препараты, нестероидные противовоспалительные препараты.
Цены на услуги Вы можете посмотреть в прайсе или уточнить по телефону, указанному на сайте.
Постковидный ревматоидный артрит
Консультация ревматолога – 1 750 руб.
Коронавирус представляет смертельную угрозу для человеческого организма. Но даже в случае выздоровления сохраняется опасность поражения различных органов и систем.
Многие из тех, кто перенес коронавирусную инфекцию, выздоравливают, но у некоторых заболевших симптомы сохраняются надолго, влияя на качество жизни.
Ученые нашли объяснение болям в суставах и мышцах, на которые жалуются некоторые пациенты с коронавирусом – инфекция вызывает аутоиммунную реакцию, которая запускает развитие ревматоидного артрита.
Как уже выяснили американские медики, новый вирус может привести к ревматологическим проблемам, требующим длительного лечения. Врачи обследовали пациентов с коронавирусом, которые с марта по декабрь 2020 года были вынуждены обращаться к ревматологам. Выяснилось, что постковидные скелетно-мышечные симптомы зачастую связаны с аутоиммунной реакцией организма.
По их мнению, ревматологические проблемы, характеризующиеся болями в суставах, возникают от того, что коронавирусная инфекция зачастую вынуждает организм атаковать самого себя. Эксперты отметили, что полученные после заражения СOVID-19 серьезные осложнения, в число которых входит ревматоидный артрит, который является результатом именно этой «атаки организма».
Ревматологам известно, что вирус (паротита, кори, гепатита В, герпеса, а теперь еще и COVID-19) может послужить пусковым фактором развития заболевания.
В норме иммунная система человека продуцирует антитела (белки), которые помогают бороться организму, разрушать вирусы, бактерии и другие чужеродные вещества.
При ревматоидном артрите иммунная система вырабатывает антитела против здоровых клеток и тканей собственного организма.
Симптомы
Поражения мышечно-скелетной системы при заражении COVID-19 полиморфны по клинической симптоматике. Это:
- припухлость сустава,
- болезненность,
- покраснение,
- локальное повышение температуры до субфебрильных значений
- суставные боли покоя
- утренняя скованность больше часа,
- общая утомляемость,
- недомогание.
Ревматоидный артрит поражает мелкие суставы, чаще кистей и стоп. Однако могут поражаться также и крупные суставы. Главный признак артрита ревматоидной природы – симметричность.
Сначала возникает воспаление внутри сустава, в результате утолщается синовиальная оболочка, затем повреждается суставной хрящ, происходит ослабление мышц, связок и сухожилий. На фоне сохраняющегося воспаления происходит разрушение костей, формирующих сустав.
При тяжелом течении болезни суставы начинают терять свою функцию, могут возникать и развиваться стойкие деформации, в результате чего снижается функциональная способность пациента и качество его жизни.
Осложнения:
- поражение внутренних органов (почки, печень, легкие, селезенка);
- воспаление сердечной сумки (перикардит);
- анемия;
- снижение иммунитета;
- остеопороз (как следствие снижения минеральной плотности костной ткани – переломы),
- вторичный остеоартроз (дегенеративные изменения сустава),
- нестабильность шейного отдела позвоночника,
- анкилоз;
- системный атеросклероз.
Диагностика
Диагноз ставится врачом-ревматологом на основании данных:
- лабораторных анализов (клинический анализ крови и СОЭ, титр С-реактивного белка, ревматоидного фактора, антител к циклическому цитрулиновому пептиду);
- УЗИ либо МРТ суставов;
- ренгенографии суставов.
Лечение
В лечении ревматоидного артрита важна своевременность. Задержка лечения на год снижает вероятность благоприятного прогноза.
Медикаментозные методы
В качестве терапии первого выбора назначаются базисные противоревматологические препараты: метотрексат, лефлуномид (арава), сульфасалазин, гидроксихлорохин. Их прием замедляет течение болезни, предотвращает костные деформации, улучшает качество жизни пациентов и прогноз заболевания. Эти препараты назначаются на неопределенный срок, иногда пожизненно.
Если речь идет об агрессивном и активном течении болезни или непереносимости высоких доз базисных препаратов, назначаются глюкокортикостероидные препараты, которые очень быстро и эффективно снимают воспаление. Последняя группа препаратов – «тяжелая артиллерия», генно-инженерные биологические препараты.
Эффективность и длительность терапии оценивает врач-ревматолог, в его задачи входит также динамическое наблюдение за пациентом.
Помимо приема препаратов, рекомендованы немедикаментозные методы терапии:
- ЛФК (не противопоказана даже в высокоактивной фазе заболевания);
- физиотерапия,
- массаж
- гидротерапия.
На поздних стадиях заболевания при неадекватной либо поздней терапии, при агрессивном течении болезни иногда необходимы хирургические методы лечения:
- синовэктомия (удаление синовиальной оболочки пораженного сустава);
- реконструктивно-пластические операции на костях, связках, сухожилиях крупных и мелких суставов;
- эндопротезирование.
Малая Балканская, д. 23 (м. Купчино)
Часы работы:
Ежедневно с 9.00 до 22.00
Дунайский проспект, д. 47 (м. Дунайская)
Часы работы:
Ежедневно с 9.00 до 22.00
Проспект Ударников, д. 19 корп. 1 (м. Ладожская)
Часы работы:
Ежедневно с 9.00 до 22.00
Выборгское ш., д. 17 корп. 1 (м. Пр-т Просвещения)
Часы работы:
Ежедневно с 9.00 до 22.00
Маршала Захарова, д. 20 (м. Ленинский пр-т)
Часы работы:
Ежедневно с 9.00 до 22.00
Реактивный артрит
- Что такое реактивный артрит?
- Реактивный артрит – это воспалительное негнойное заболевание суставов, которое развивается после острой кишечной или мочеполовой инфекции.
- Как часто встречается реактивный артрит?
Среди ревматических болезней реактивный артрит является самым распространенным заболеванием. Его распространенность составляет 86,9 человек на 100 тысяч детей.
Чаще всего заболевают мальчики-подростки и молодые мужчины.
Почему возникает реактивный артрит?
Одной из наиболее частых причин развития реактивных артритов является хламидийная инфекция. В детском возрасте хламидийные артриты составляют до 80%.
Дети и взрослые могут заражаться хламидиями при контакте с людьми – носителями инфекции, с также от животных (кошек, собак), птицы.
Заражение происходит воздушно-капельным, воздушно-пылевым, половым, контактно-бытовым путем, а также во время прохождения плода через инфицированные родовые пути матери.
Вторыми по частоте встречаемости возбудителями реактивного артрита являются кишечные микроорганизмы. К возбудителям кишечного реактивного артрита относят иерсинии, сальмонеллы, шигеллы, кампилобактер.
Как проявляется реактивный артрит?
Обычно при расспросе больного можно выяснить, что за 1-3 недели до появления суставных проявлений больной перенес ОРЗ, кишечное расстройство или отмечались нарушения мочеиспускания (болезненность, учащение мочеиспусканий).
Сам реактивный артрит начинается остро, повышается температура, ухудшается общее состояние. Поражаются крупные суставы нижних конечностей — коленные, голеностопные, пяточные, плюснефаланговые и межфаланговые, реже суставы рук.
Чаще всего воспаляются суставы нижних конечностей, особенно пальцев стоп, где также развивается отек, распространяющийся на весь палец, и синюшная или багрово-синюшная окраска кожи (палец становится похожим на сосиску или редиску).
Помимо артритов, характерно развитие энтезопатий — воспаления сухожилий в местах их прикрепления к костям, особенно часто в пяточной области. У некоторых больных возможно появление болей в области позвоночника.
Во многих случаях реактивный артрит непродолжителен (от нескольких дней до нескольких недель), проходит на фоне лечения, но у некоторых больных может стать хроническим.
- При болезни Рейтера — типичной форме реактивного артрита, наряду с суставными проявлениями отмечаются признаки уретрита и поражения глаз (конъюнктивит и более тяжелые формы).
- Варианты поражение глаз при болезни Рейтера могут быть следующими: конъюнктивит (воспаление конъюнктивы глаза) — чаще всего не гнойный, с необильным отделяемым, быстро проходящий; рецидивирующий иридоциклит (воспаление радужки и реснитчатого тела) – разновидность увеита с благоприятным течением; панувеиты (воспаление всех слоев сосудистой оболочки глаза – радужки, ресничатого тела, хориоидеи) с отслойкой сетчатки, вплоть до потери зрения.
- Для увеита характерно покраснение глаз, светобоязнь, слезотечение, проходящее снижение или затуманивание зрения, изменением цвета глаза, изменение формы и величины зрачка.
- Внесуставные проявления характеризуются поражением кожи чаще в виде сыпи, слизистых оболочек полости рта (стоматит), сердца, периферической нервной системы (неврит); кожи (куратодермия).
- Опасен ли реактивный артрит?
- Прогноз для жизни и длительного сохранения функциональной способности в целом благоприятный.
- Факторами неблагоприятного прогноза при реактивном артрите считаются: частые обострения суставного синдрома, наследственная предрасположенность к ревматическим заболеваниям, носительство HLA-B27 антигена, неэффективность противовоспалительной и антибактериальной терапии.
- Смертельные исходы при реактивном артрите встречаются редко, основная причина – развитие осложнений, в частности поражение сердца (кардит, миокардит).
- Для уменьшения риска развития осложнений и предотвращения перехода острого течения реактивного артрита в хронический необходимо своевременное и адекватное лечение инфекционного процесса воспалительного процесса, что требует постоянного наблюдения врача- ревматолога.
- Как диагностируют реактивный артрит?
- Диагноз болезни Рейтера или реактивного артрита ставится на основании данных о предшествующей инфекции, анализа особенностей клинической картины, данных лабораторных и инструментальных методов обследования и результатов на наличие возбудителя.
- Какие существуют методы лечения реактивного артрита?
- Целью лечения при реактивном артрите является ликвидация инфекционного агента, излечение или достижение стойкой клинико-лабораторной ремиссии.
Лечение больного реактивным артритом должно проводиться в условиях специализированного стационара. Лечение реактивного артрита консервативное и включает в себя использование антибактериальных препаратов, нестероидных противовоспалительных средств, по показаниям глюкокортикоидов. В период стихания острых воспалительных явлений показаны ЛФК, массаж.
Одним из основных методов лечения является назначение антибактериальных препаратов. Так как хламидия является микроорганизмом с особым типом жизнедеятельности, то выбор антибактериальных препаратов ограничен. К таким антибиотикам относятся макролиды, тетрациклины и фторхинолоны.
Однако, тетрациклины и фторхинолоны достаточно токсичны, обладают побочными эффектами, которые ограничивают их применение в детской практике. В связи с этим наиболее часто для лечения хламидиоза у детей используются макролиды. У детей старше 8 лет возможно использование тетрациклинов.
Терапия антибиотиком более эффективна в острой стадии синдрома Рейтера.
При затяжном и хроническом течении реактивного артрита терапия антибиотиками оказывается недостаточно эффективной.
У больных с хроническим течением реактивного артрита иммунная система функционирует неадекватно, патологические реакции преобладают над защитными. Учитывая эти особенности, для лечения хронического хламидийного артрита используют различные иммуномодулирующие средства. Однако, их применение должно быть чрезвычайно аккуратным, только по назначению врача.
Для лечения реактивных артритов хламидийной этиологии у детей разработаны и схемы терапии с использованием Тактивина, глюкозаминилмурамилдипептид, N-окси поли-1,4-этиленпиперазина. Назначение иммуномодуляторов стимулирует защитные свойства организма и повышает общую сопротивляемость.
Назначение антибиотиков и иммуномодуляторов, не решает общей проблемы лечения реактивного артрита. Так как исчезновение хламидий из мочеполовых органов еще не означает полного излечения.
Компоненты (антигены) микроорганизмов сохраняются дольше, чем сам возбудитель. Необходимы контрольные исследования через один, два, три месяца после окончания лечения. При необходимости возможны повторные курсы антибиотиков и иммуномодуляторов.
Принять решение о необходимости повторного курса может принять только врач.
Всем детям с реактивным артритом, у которых выявляются антитела к бактериям кишечной группы в диагностических титрах или при бактериологическом обследовании кала высеваются бактерии кишечной группы, целесообразно проведение антибактериальной терапии. Препаратами выбора являются аминогликозиды.
Кроме терапии направленной на ликвидацию инфекции, назначается симптоматическая терапия.
Нестероидные противовоспалительные препараты. Назначаются с целью уменьшения болевого синдрома всем пациентам. Препараты назначаются на острый период. Доза препарата рассчитывается в зависимости от возраста и веса больного.
Стероидные противовоспалительные препараты. Наиболее мощным и быстрым противовоспалительным эффектом обладают глюкокртикостероиды. Они являются препаратами выбора при необходимости быстро купировать активность заболевания, болевой синдром, развивающиеся осложнения. Основной путь введения глюкокортикоидов при реактивном артрите – внутрисуставно.
Иммуноподавляющие препараты.
При непрерывном обострении суставного синдрома, наличии энтезопатий, ограничении подвижности позвоночника (ребенок не достает кончиками пальцев рук до пола более 15см), воспалительных изменений в анализах крови и неэффективности стандартной терапии, — показано назначение иммуноподавляющих препаратов. Препаратом выбора является Сульфасалазин. Назначается и отменяется только врачом. Лечение проводится длительно (годами), под контролем показателей общего и биохимического анализов крови для предотвращения развития побочных эффектов.
Первичная профилактика – не разработана. Основная направленность — предупреждение развития заболевания:
- Здоровый образ жизни
- Санация очагов инфекции.
- Соблюдение правил личной гигиены
- Лечение родителей от хламидиоза
- Иммуногенетическое консультирование и выявление родителей носителей HLA-B27 антигена
- Планирование семьи
Вторичная профилактика – предупреждение рецидивов заболевания
- Здоровый образ жизни
- Соблюдение правил личной гигиены
- Ранее обращение к врачу
- Выполнение рекомендаций врача-ревматолога
- Не заниматься самолечением