Сегодня уже стало аксиомой утверждение, что препараты от рака не способны уничтожить этот недуг на 100%. И причина не в том, что все они оказывают одинаковый эффект. Фармакология не стоит на месте. Ученые всего мира не устают работать над созданием средства более совершенного, чем его предшественники. Каждый год на мировом рынке появляются всё новые лекарства. О них и поговорим подробнее.
Борьба с раковыми опухолями
Еще полвека назад, любые патологические образования удалялись из организма хирургическим методом. Опухоль попросту вырезали. И так происходило до тех пор, пока не появлялись метастазы и болезнь не переходила в неоперабельную стадию. Затем нашли способ не применять столь радикальный метод.
На помощь операциям пришла химиотерапия. Вводя в организм онкобольного специальные ядовитые вещества, врачи останавливали рост раковых клеток и опухоль переставала увеличиваться в размерах.
Метод действенный, но у него есть немалый список побочных эффектов.
Яды, которые входят в состав препаратов для химиотерапии, запатентованы, но ученые продолжают искать новые комбинации, стремятся получить такой же эффективный, но с меньшим количеством побочных явлений.
Медицинский центр Imedical сегодня предоставляет уникальную возможность диагностики и лечения рака в Израиле. Вы можете связаться с нами для получения подробной консультации.
Отправьте заявку с сайта или позвоните по телефонам: +7 499 322 72 42 (в России) или + (972) 528 282 416 (Viber, WhatsApp)
Сегодня достаточно велико разнообразие лекарств, помогающих организму бороться с чуждыми ему раковыми клетками. Однако из-за их высокой стоимости, купить препараты от рака может далеко не каждый.
Фармацевтические компании стремятся не только помочь онкобольным, но и не упустить свою выгоду от продажи жизненно важного лекарства. В последние годы врачи израильского медцентра им. Сураски (Ихилов) стали замечать следующую тенденцию: каждое новое средство помогает лучше предыдущего.
Исключения из правила бывают, но в целом новейшие разработки ученых оказываются более эффективными.
Еще одна особенность – современные препараты не убивают раковые клетки, а блокируют их, лишают питания, создают препятствия для дальнейшего деления и роста. Всё чаще применяется таргетная терапия, она оказывает целенаправленное, точечное, воздействие на опухоль.
Сегодня лечить рак без операции – это возможно. Однако хирургическое лечение всегда является приоритетным в лечении онкологии. Химио-, био- и иммунолечение применяется тогда, когда уже нельзя сделать операцию или когда это лечение дают в помощь хирургическому.
Новые препараты в лечении рака не всегда оказываются эффективными, но ученые не оставляют надежду создать препарат, который поможет спасти человечество от смертельно опасного заболевания.
Итак, наука не стоит на месте. Рак- это смертельно опасное заболевание, от появления которого никто не застрахован.
Его формы и варианты разнообразны, и есть множество лекарств, способных облегчить страдания людей, но пока еще ни один новый препарат от рака не уничтожает опухоль полностью и не может предотвратить появление рецидива. А значит, ученым еще есть над чем работать, а онкобольным не стоит терять надежду.
Самое главное своевременно выявить заболевание на ранней стадии и обратиться к онкологу.
Не теряйте драгоценное время, вы можете связаться с нами для бесплатной и квалифицированной консультации.
Мы поможем оперативно выявить болезнь, назначим лечение и спасем вам жизнь!
Что бы записаться на обследование или задать любые вопросы, касающиеся диагностики и лечения онкологического заболевания, отправьте заявку с сайта или позвоните
по телефонам: +7 499 322 72 42 (в России) или + (972) 528 282 416 (Viber, WhatsApp)
Противоопухолевые препараты ингибиторов роста рака
- ингибиторы тирозинкиназы;
- ингибиторы протеасы;
- ингибиторы MTOR;
- ингибиторы PI3K (фосфатидилинозитол-3-киназы).
Достать лекарства от рака с гарантией оригинального происхождения препарата просто, если вы обратились в компанию Tlv.Hospital.
Мы предлагаем сертифицированные фармацевтические группы для традиционных методов коррекции онкологии и реализации авторских программ.
Закажите ингибиторы (блокаторы) роста раковых новообразований для выполнения терапевтического протокола в отечественной клинике или оформитесь на лечение в Израиле через официального представителя Израильской ассоциации компаний медицинского туризма — сервис Tlv.Hospital.
Факторы роста опухоли
Факторы роста – это химические вещества, производимые организмом для контроля роста клеток. Существует много различных типов факторов роста, и все они работают по-разному.
Некоторые из них передают информацию, каким видом клетки должна стать данная, конкретная клетка.
Другие побуждают клетки расти и делиться; есть те, которые передают информацию, когда клетка должна перестать расти или умереть.
Факторы роста работают, подключаясь к рецепторам на поверхности клеток. Они посылают сигнал внутрь клетки, запуская целую сеть сложных химических реакций.
Существует целый ряд различных факторов роста:
- Эпидермальный фактор роста (EGF) – контролирует рост клеток.
- Фактор роста эндотелия сосудов (VEGF) — координирует развитие кровеносных сосудов.
- Тромбоцитарный фактор роста (PDGF) — контролирует развитие сосудов и рост клеток.
- Фактор роста фибробластов (FGF) – отвечает за рост клеток.
Каждый фактор роста присоединяется к соответствующим рецепторам на поверхности клетки, чтобы оказывать воздействие на нее.
Ингибиторы факторов роста блокируют факторы, которые дают сигнал раковым клеткам делиться и расти. Ученые разрабатывают различные способы, чтобы осуществить это:
- Снизить содержание факторов роста в организме.
- Блокировать рецепторы факторов роста на клетке.
- Противодействовать сигналам внутри клетки.
Большинство этих методов работают, блокируя процессы передачи сигнала, которые используют злокачественные клетки, чтобы начать деление.
Раковые клетки обладают повышенной чувствительностью к факторам роста опухоли. Поэтому если есть возможность заблокировать их, можно остановить рост некоторых видов онкологии. Ученые разрабатывают различные ингибиторы для разных типов факторов роста.
Есть сложности с классификацией различных типов биологической терапии, поскольку они часто пересекаются. Некоторые ингибиторы факторов роста блокируют рост кровеносных сосудов в растущей опухоли. Такое же действие оказывают моноклональные антитела.
Существуют различные типы ингибиторов, их можно сгруппировать в соответствии с химическими веществами, которые они блокируют.
Виды ингибиторов роста рака
Противоопухолевые препараты — ингибиторы тирозинкиназы
Ингибиторы тирозинкиназы также называют ИТК. Они блокируют ферменты под названием тирозинкиназы. Эти ферменты помогают передавать сигналы роста к клеткам. Таким образом, предотвращают рост и деление клетки. Может быть блокирован один тип тирозинкиназы или несколько. ИТК, оказывающие воздействие на несколько видов ферментов, называют мультиингибиторами.
ИТК, которые применяют в лечебной практике, а также в рамках клинических испытаний:
- Afatinib (Giotrif)
- Axitinib (Inlyta)
- Bosutinib (Bosulif)
- Crizotinib (Xalkori)
- Дазатиниб (Sprycel)
- Эрлотиниб (Tarceva)
- Гефитиниб (Иресса)
- Иматиниб (Гливек)
- Лапатиниб (Tyverb)
- Нилотиниб (Tasigna)
- Pazopanib (Votrient)
- Регорафениб (Stivarga)
- Сорафениб (Nexavar)
- Сунитиниб (Сутент)
Данные препараты принимают в таблетках или в капсулах, обычно один или два раза в день.
Противоопухолевые препараты — ингибиторы протеасомы
Протеасомы – крошечные структуры всех клеток, по форме напоминающие бочку. Они помогают расщеплять белки, которые не нужны клетке, на более мелкие части. Эти белки потом используются для создания новых, необходимых белков. Работу протеасом блокируют ингибиторы протеасом. Это вызывает накопление нежелательных белков в клетке, приводя к ее смерти.
Бортезомиб (Velcade) – ингибитор протеасом, который применяют в лечении меланомы. В организм его вводят внутривенно.
Получить консультацию врача
Противоопухолевые препараты — ингибиторы MTOR
MTOR – тип белка под названием протеинкиназа. Он воздействует на клетки, чтобы они синтезировали химические вещества под названием циклины, которые способствуют развитию клеток. Кроме того, они содействуют синтезу белков клетками, провоцирующих развитие новых кровеносных сосудов, которые необходимы опухолям.
Некоторые типы белка mTOR одновременно способствуют росту злокачественных клеток и созданию новых сосудов. Ингибиторы таких белков являются инновационными препаратами, блокирующими рост опухолевого процесса. К ингибиторам данного белка относят:
- Темсиролимус (Torisel)
- Эверолимус (Afinitor)
- Deforolimus
Противоопухолевые препараты — ингибиторы PI3K
PI3K (фосфатидилинозитол-3-киназы) – группа близкородственных белков киназ. Они выполняют несколько действий в клетках. Например, активируют другие белки – к примеру, mTOR. Активация PI3K приводит к росту и делению клеток, развитию кровеносных сосудов, помогает клеткам передвигаться.
При некоторых видах рака PI3K постоянно активированы, что означает бесконтрольный рост раковых клеток.
Исследователи разрабатывают новые методы лечения, которые блокируют PI3K, что останавливает рост злокачественных клеток и приводит к их гибели.
Этот тип ингибитора пока доступен только в рамках клинических испытаний. Необходимо некоторое время, прежде чем убедиться, что препарат эффективен в лечении рака.
Противоопухолевые препараты — ингибиторы гистондеацетилазы
Ингибиторы гистондеацетилазы также называют ингибиторами HDAC или HDIS, ингибиторами селективного действия. Они блокируют действие группы ферментов, которые удаляют вещества из ацетильной группы конкретных белков. Это останавливает рост и деление злокачественных клеток, а иногда и полностью их уничтожает.
Ингибиторы гистондеацетилазы – новый тип ингибиторов факторов роста. Препараты, которые используются в лечении рака и в рамках клинических испытаний:
- Vorinostat (Zolinza)
- Belinostat
- Panobinostat
- Entinostat
- Mocetinostat
Противоопухолевые препараты — ингибиторы Hedgehog pathway
Данные блокаторы нацелены на группу белков под названием Hedgehog pathway. У развивающегося эмбриона эти белки посылают сигналы, которые помогают клеткам расти в правильном направлении и в правильном месте.
Данный белок также контролирует рост кровеносных сосудов и нервов. У взрослых Hedgehog pathway обычно не активен. Но у некоторых людей изменения в генах включают его.
В настоящее время разработаны блокаторы Hedgehog pathway, которые выключают белок и останавливают рост рака.
Этот вид биологической терапии достаточно новый. Vismodegib (Erivedge) – пример такого ингибитора, участвующего в клинических испытаниях.
Ингибиторы ангиогенеза
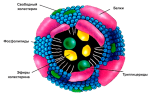
Опухоль нуждается в хорошем кровоснабжении, чтобы поступали питательные вещества, кислород и удалялись отходы. Когда она достигает в ширину 1-2 мм, ей необходимо вырастить новые кровеносные сосуды, чтобы увеличить объем необходимых поступающих веществ.
Некоторые раковые клетки создают белок под названием фактор роста эндотелия сосудов (VEGF). Этот белок прикрепляется к рецепторам на клетках, выстилающих стенки кровеносных сосудов внутри опухоли. Эти клетки называются эндотелиальными.
Они дают импульс к росту кровеносных сосудов, чтобы опухоль могла расти.
Ангиогенез означает рост новых кровеносных сосудов. Если удается остановить создание новых сосудов, снижается рост опухолевого процесса, а иногда и уменьшается. Ингибиторы ангиогенеза как раз направлены на остановку создания новых кровеносных сосудов у опухоли.
Типы инигибиторов
Существуют разные препараты, блокирующие рост кровеносных сосудов:
- Ингибиторы, блокирующие фактор роста (VEGF) от присоединения к рецепторам на клетках, выстилающих кровеносные сосуды. Это останавливают развитие сосудов. Таким препаратов является бевацизумаб (Авастин), которые также представляет собой моноклональное антитело.
- Ингибиторы, блокирующие передачу сигналов. Некоторые препараты останавливают передачу сигналов о росте от VEGF рецепторов к клеткам кровеносных сосудов. Такие препараты также называют блокаторами факторов роста или ингибиторами тирозинкиназы. Сунитиниб (Сутент) – один из видов ИТК, блокирующий сигналы роста внутри клеток кровеносных сосудов. Его применяют в лечении рака почек и при редком типе рака желудка – стромальных опухолях.
- Ингибиторы, влияющие на передачу сигналов между клетками. Некоторые препараты оказывают действие на химические вещества, которые клетки используют, чтобы подавать сигналы о росте друг другу. Это может остановить процесс развития кровеносных сосудов. Такими препаратами являются талидомид и леналидомид (Revlimid).
Возможные побочные эффекты ингибиторов факторов роста
Все препараты способны вызывать побочные эффекты, у всех – разные. Но есть несколько общих потенциальных нежелательных последствий:
- усталость;
- диарея;
- сыпь на коже или потеря цвета;
- стоматит;
- слабость;
- утрата аппетита;
- низкие показатели крови;
- отеки.
Гибридный препарат позволит лечить онкологию без побочных эффектов — Газета.Ru | Новости
Лечение онкологии стандартным методом химиотерапии не только уничтожает злокачественные клетки, но и повреждает здоровые. Для решения проблемы российские ученые разработали химически «сшитые» вещества, способные избирательно накапливаться в «энергетических станциях» раковых клеток — митохондриях.
Липофильный катион транспортирует вещество в клетки, а функционально активный компонент, бетулиновая кислота, провоцирует их гибель. Предполагается, что препарат будет воздействовать только на злокачественные клетки, что в будущем дает возможность лечения онкологии без тяжелых побочных эффектов.
Результаты работы, выполненные при финансовой поддержке гранта Президентской программы Российского научного фонда (РНФ), опубликованы в журнале Free Radical Biology and Medicine.
Один из наиболее широко применяемых методов лечения онкологии — химиотерапия. Пациенту вводится препарат, останавливающий рост и деление клеток опухоли, а также их распространение по организму.
Однако у химиотерапии есть существенный недостаток: она негативно влияет не только на раковые, но и на здоровые клетки.
В итоге последние разрушаются, что приводит к серьезным повреждениям и нарушениям работы внутренних органов человека, включая печень, почки и сердце.
Поэтому ученые ищут препараты, которые позволили бы свести побочные эффекты к минимуму. Один из возможных подходов — сочетание компонентов с разной активностью и свойствами.
Можно просто смешать соединения, а можно химически их сшить, то есть получить синтетический конъюгат. Такая молекулярная гибридизация показала хорошие результаты в разработке противомикробных, противовирусных и противоопухолевых средств.
Кроме того, она позволяет получать соединения, воздействующие на определенные типы клеток.
Липофильные конъюгаты «боятся воды», но при этом хорошо сочетаются с липидами, или жирами. Поскольку липиды составляют основу клеточной мембраны, липофильность необходима препарату для взаимодействия с клетками — как на поверхности, так и для проникновения внутрь.
Авторы статьи синтезировали с небольшими отличиями в химической формуле несколько видов новых конъюгатов (F1, F6 и F8) на основе бетулиновой кислоты. Это вещество обладает противоопухолевым действием, а получают его из бетулина, благодаря которому стволы берез имеют белую окраску.
Молекула напрямую действует на митохондрии — «энергетические станции» опухолевых клеток, инициируя в них образование активных форм кислорода. Последние очень сильно повреждают клетку и вызывают ее разрушение. Однако сама по себе бетулиновая кислота плохо проходит через мембрану клеток и недостаточно эффективно действует на митохондрии.
Для увеличения активности вещества ее «сшили» с липофильным катионом F16, который способен направленно проникать в «энергетические станции» опухолевых клеток.
«Мы протестировали новые соединения на клетках, выделенных из вилочковой железы крыс, оценив их жизнеспособность после обработки.
Синтезированные нами вещества провоцируют массивную выработку активных форм кислорода в клетках, что приводит к их гибели», — рассказал Михаил Дубинин, один из авторов статьи, кандидат биологических наук, доцент кафедры биохимии, клеточной биологии и микробиологии Марийского государственного университета (Йошкар-Ола).
Все полученные производные F16 и бетулиновой кислоты более чем десятикратно превосходят по эффективности исходные соединения. Особого внимания заслуживает конъюгат F6, самый сильно действующий в серии тестируемых соединений.
Эффект этого вещества основан на нескольких процессах: так, оно подавляет клеточное дыхание, провоцируя гибель клеток, и одновременно запускает механизмы, способствующие нарушению целостности мембран митохондрий и через каскад реакций приводящие к их самоуничтожению.
«Митохондрии некоторых опухолевых клеток отличаются по своим свойствам от митохондрий здоровых, и именно на эти свойства «реагируют» полученные нами вещества.
Это позволяет надеяться, что препарат будет накапливаться в злокачественных клетках и не причинит вреда здоровым, что сведет побочные эффекты от противораковой терапии к минимуму», — подвела итог руководитель по гранту РНФ Дарья Недопекина, кандидат химических наук, научный сотрудник лаборатории органического синтеза института нефтехимии и катализа УФИЦ РАН (Уфа).
На следующем этапе ученых ожидают испытания новых препаратов на модельных животных. Они позволят сделать заключение о перспективности использования новых агентов в терапии рака различного происхождения.
Новые открытия дают надежду на лечение рака без побочных эффектов
Ученые всего мира пытаются найти лекарство от рака. Только в США сейчас ведется более 210 проектов, связанных с лечением онкологических заболеваний, с совокупным годовым бюджетом более $116 млн. Мы проштудировали новейшие исследования и выяснили, какие открытия произошли за минувший год.
Что нового в науке о раке?
Главная проблема в лечении онкологических заболеваний состоит в том, что рак проявляет себя индивидуально у каждого человека, даже когда он поражает одну и ту же ткань. Эти межличностные различия определяют, будет ли конкретная терапия эффективно убивать рак и помогать пациенту.
Большинство ученых уверены, что причиной возникновения злокачественных опухолей являются мутации в клетках. На данный момент генетики составили список предполагаемых раковых генов — их идентифицировано порядка 1000, а в апреле 2021 года этот перечень пополнился еще 165 «виновниками».
Раковые гены были идентифицированы с помощью искусственного интеллекта. Всего компьютер проанализировал десятки тысяч различных сетевых карт для 16 различных типов рака, каждая из которых содержала от 12 000 до 19 000 точек данных. Эта работа немецких ученых открывает новые перспективы для таргетной терапии рака в персонализированной медицине, а также служит для определения биомаркеров.
Чтобы лучше понять, как развивается рак в человеческом организме, ученые из Гарвардской медицинской школы «отмотали» историю болезни назад для двух человек, у которых онкологическое заболевание было выявлено в 34 и 63 года. Исследователи реконструировали эволюцию их раковых клеток, проследив хронологию мутации, которая вызывает заболевание и выяснили следующее.
У более молодого пациента онкология началась с мутации в одной-единственной клетке в девятилетнем возрасте. А у более пожилого пациента злокачественный процесс запустился в 19 лет
За 44 года рак прошел в его организме большой путь, развившись из одной клетки до значительной опухоли.
«Изначально есть одна клетка, которая имеет мутацию. В течение следующих десяти лет там будет около 100 раковых клеток, — объясняет соавтор исследования Саханд Хормоз. — Но со временем их число растет экспоненциально и исчисляется тысячами и тысячами.
У нас было мнение, что раку требуется очень много времени, чтобы стать явным заболеванием, но до сих пор никто не показывал этого так детально». Ученый отметил, что для него самое захватывающее — это думать о том, в какой момент можно заметить эти раковые опухоли.
«Если пациенты приходят в клинику через 40 лет после того, как их мутация впервые развилась, могли ли мы поймать ее раньше? И можем ли мы предотвратить развитие рака до того, как пациент узнает о своем диагнозе?» — говорится в исследовании, опубликованном в марте этого года.
Нет более сильного фактора риска развития рака, чем возраст: средний возраст пациентов по всем видам рака составляет 66 лет на момент постановки диагноза.
По последним данным, рак все-таки можно попытаться предотвратить. Одно из исследований показало, что один из восьми пациентов с раком имеет наследственные генетические мутации.
Их можно выявить с помощью генетического тестирования — это поможет выбрать тактику профилактики, подобрать индивидуальные методы лечения рака, улучшить выживаемость и снизить риски онкологии у близких родственников.
Ученые считают, что по крайней мере один из трех основных видов рака (27–39%) можно предотвратить, улучшив диету, физическую активность и состав тела. Речь идет о здоровом образе жизни и правильном питании.
В исследованиях, посвященных профилактике рака, фигурируют: средиземноморская диета, достаточное потребление грибов, снижение употребления мяса и сыра, отказ от жирной пищи, контроль за уровнем сахара и холестерина в организме, достаточный уровень витамина D, здоровый сон без ночных смен, лечение от патогенной бактерии H. pylori, которая обитает в желудках у половины населения Земли, здоровый микробиом. Как выяснилось недавно, к раку может приводить хроническое воспаление, вызванное инфекцией или такими состояниями, как хроническое воспалительное заболевание кишечника — оно связано с 25% всех видов рака. Женщины могут лучше защититься от рака яичников и эндометрия, если используют оральные контрацептивы. Правда, тут есть и негативный момент: при приеме оральных контрацептивов несколько возрастает риск рака молочной железы.
Новейшие данные раскрывают основные сложности лечения. В одном из исследований, вышедшем в апреле 2021 года, ученые ответили на вопрос о том, почему некоторые лекарства от рака излечивают мышей в лабораторных опытах, но не помогают людям в медицинской практике.
Все дело в том, что человеческая опухоль и опухоль в грызуне не совпадают: в животном раковые клетки заражены мышиными вирусами и реагируют иначе. Поэтому результаты лечения выглядят многообещающими, а в дальнейшем препарат может оказаться неэффективным. Еще одно печальное открытие 2021 года: раковые клетки впадают в спячку, как медведи.
Они могут затаиться и пережить суровую химиотерапию, а через несколько лет выйти из спящего режима. «Опухоль действует как целый организм, способный перейти в состояние спячки, сохраняя энергию, чтобы выжить», — пояснила исследователь и хирург Кэтрин О'Брайен из Онкологического центра принцессы Маргарет (Канада).
О таком коварстве рака молочной железы уже заявляли ученые в 2019 году. Изучение этого механизма необходимо, чтобы справиться с проблемой рецидивов.
Прорывы в лечении
Лечение рака без побочных эффектов — заветная мечта всех онкологов мира. Ученые не первое десятилетие ищут альтернативу химиотерапии, которая, убивая опухоль, наносит ущерб здоровым органам. Кратко перечислим инновационные и экспериментальные методы, которые показали эффективность в лабораториях за минувший год и, вполне возможно, станут частью медицины ближайшего будущего.
Ученые из Университета Пердью (США) выделили противораковое вещество из кустарника Jatropha curcas — американского эндемика, произрастающего также в Африке и Азии.
Растение издавна использовалось в народной медицине, а теперь оказалось эффективным оружием против ранее непобедимого белка BRAT1, который свойственен многим видам рака (груди, головного мозга, толстой кишки, простаты, легких и печени).
Соединение, относящееся к семейству куркузонов, полученное из американского кустарника, может не только убить раковые клетки, но и остановить их миграцию. «Если мы сможем предотвратить метастазирование рака, пациент сможет прожить дольше», — говорят авторы исследования.
Правда, есть одна техническая проблема: чтобы получить хотя бы четверть чайной ложки противоракового соединения, нужно как минимум 45 кг кустарника.
Биологи из Соединенного Королевства указали еще на одно вещество, которое способно останавливать рак: в природе оно содержится в мясе, бобовых и злаковых культурах и называется гексафосфат инозитола, или IP6.
Ученые проверили его влияние на ген BMI1, который отвечает за деление некоторых типов стволовых клеток крови и нервной системы и связан с медуллобластомой — онкологическим заболеванием головного мозга.
При развитии медуллобластомы активность гена BMI1 увеличивается и раковые клетки начинают активно делиться, но одновременно они становятся уязвимыми к IP6. Вещество оказалось способным останавливать рост опухоли и повышать эффективность противоракового средства цисплатина.
В2021 году шотландские ученые из Университета Хериота — Уатта в Эдинбурге предложили удалять раковые клетки сверхточным лазером. Совет по исследованиям в области инженерных и физических наук выделил на эту разработку £1,2 млн.
Лазерная установка позволяет хирургам уничтожать раковые клетки размером меньше человеческого волоса, не повреждая соседние ткани.
Технология успешно опробована в терапии колоректального рака и скоро будет применяться для лечения рака мозга.
Еще одной альтернативой химиотерапии может стать метод паутины, разработанный в Институте исследований полимеров им. Макса Планка.
Ученые придумали способ нарушить структуру раковых клеток, чтобы активировать механизм их саморазрушения. Своеобразная «паутина», растущая внутри злокачественных клеток, деформирует их изнутри.
«Мы атакуем раковую клетку таким способом, от которого она не может защититься», — говорят авторы исследования.
Новая лучевая терапия была испытана в 2020 году и стала прорывом в области радиационных наук за три-четыре последних десятилетия.
Исследователи из Калифорнийского университета в Ирвине и Швейцарской университетской больницы Лозанны использовали сверхвысокую мощность дозы лучевой терапии для устранения опухолей головного мозга у мышей без побочных эффектов, которые обычно связаны с этой процедурой.
«Вполне разумно ожидать, что через десять лет это может стать широко распространенным вариантом для пациентов с лучевой терапией во всем мире», — заявил один из авторов нового метода.
Система редактирования генома на основе CRISPR, за которую недавно дали Нобелевскую премию, оказалась эффективна в лечении метастатического рака. В этом убедились исследователи из Тель-Авивского университета: они разработали новую систему доставки липидов на основе наночастиц, которая специально нацелена на раковые клетки и уничтожает их с помощью генетических манипуляций.
«Это первое в мире исследование, доказавшее, что система редактирования генома CRISPR может быть эффективно использована для лечения рака у живого животного», — сказал профессор Дж. Пэр.
«Следует подчеркнуть, что это не химиотерапия. Нет никаких побочных эффектов, и раковые клетки, обработанные таким образом, никогда больше не станут активными»
«»Молекулярные ножницы» Cas9 разрезают ДНК раковой клетки, тем самым нейтрализуя ее и навсегда предотвращая репликацию», — добавил он.
Выживаемость мышей при таком лечении увеличилась на 30% у особей с опухолями головного мозга — глиобластомой — и на 80% у особей с метастатическим раком яичников.
Ученые специально взяли самые агрессивные и смертоносные виды рака, чтобы продемонстрировать потенциал «молекулярных ножниц» CRISPR. Теперь они планируют заняться раком крови. Кстати, большинство вакцин от COVID-19 сделаны по схожей технологии.
В том же Тель-Авивском университете в минувшем году опробовали еще одно экспериментальное лечение рака. Техника сочетает в себе применение ультразвука, внедрение в опухоль микропузырьков, которые прикрепляются к раковым клеткам и взрываются, и особого гена — активатора иммунной системы.
Исследователи сравнивают микропузырьки с умными нацеленными боеголовками, которые при низкочастотном ультразвуке (250 кГц) активируются, создавая дыры в мембранах раковых клеток, обеспечивая доставку генов.
Разрушение клеток достигало 80% опухолевых клеток, а оставшиеся уничтожал специальный ген иммунотерапии, который действовал как троянский конь и давал сигнал иммунной системе атаковать раковые клетки.
«Большинство раковых клеток были разрушены взрывом, а оставшиеся клетки потребляли ген иммунотерапии через отверстия, которые были созданы в их мембранах, — объяснил один из авторов метода доктор Илович. — Ген заставил клетки вырабатывать вещество, которое активировало иммунную систему, чтобы атаковать раковую клетку.
На самом деле у наших мышей опухоли были с обеих сторон тела. Несмотря на то что мы проводили лечение только с одной стороны, иммунная система атаковала и дальнюю сторону». Проведенное в течение двух лет исследование подготовило неинвазивную технологическую платформу для доставки генов в клетки рака молочной железы. По словам исследователей, в будущем таким методом можно будет лечить опухоли головного мозга и другие нейродегенеративные заболевания, такие как болезни Альцгеймера и Паркинсона.
Еще одно оружие против рака — инфракрасный свет — применили специалисты Нагойского университета.
В сочетании с противораковым соединением этот метод оказался эффективным в лечении редкого типа рака легких — злокачественной мезотелиомы плевры.
Он редко распространяется на другие части тела, но обычно диагностируется слишком поздно, что приводит к плохому прогнозу и очень ограниченным возможностям лечения.
Совершенствуются методы иммунотерапии, ведь иммунная система организма — это первая линия защиты от бактерий, вирусов или онкологических заболеваний. Некоторые типы рака развили искусство молекулярного обмана, чтобы избежать разрушения иммунной системой организма, — они научились имитировать нормальные клетки и производить сигнал «не ешь меня!».
Ученые из Университета Миссури нашли новый способ помочь иммунной системе организма преодолеть этот обман. Инновационная иммунотерапия — это лекарство, которое, по сути, блокирует сигнал «не ешь меня!», исходящий от рака, и позволяет иммунной системе убить его.
Решению этой задачи помог 50-летний штамм бактерий, которые в ходе лечения ученые могут генно-модифицировать под конкретного пациента.
Остается надеяться, что какой-то из этих способов станет не только удачным лабораторным опытом, но и действующей медицинской технологией, спасающей жизни людей. По данным ВОЗ, в 2020 году от онкологических болезней умерли 10 млн человек.
Антибиотики перестают помогать, но есть дурнопахнущая альтернатива
Ген, это ты виноват!
Нмиц онкологии им. н.н. блохина — лекарственная терапия
С помощью лекарств сегодня лечат большинство опухолей. Это самый универсальный и самый распространенный метод лечения рака в силу его особенностей:
- простоты введения пациенту (внутривенно или перорально);
- доступа лекарства одномоментно во все клетки и ткани организма;
- возможности на любом этапе корректировать дозу и режим введения препарата или менять лекарство;
- снижения риска выживания злокачественных клеток (клеток рака) в труднодоступных и удаленных местах и возобновления роста опухоли.
Виды лекарственной терапии
С развитием нанотехнологий, молекулярной медицины и генной инженерии в портфеле онкологов появились множество новых противоопухолевых препаратов, лекарства стали более избирательными к злокачественным клеткам и менее токсичными для здоровых тканей и организма в целом. Появились прицельные лекарства, так называемые таргетированные, молекулы которых воздействуют более избирательно на клетки рака.
Все лекарства против рака по механизму действия делят на цитостатические и цитотоксические.
Первые, цитостатические, тормозят размножение злокачественных клеток и вызывают их апоптоз, или программу самоуничтожения, клеточный распад.
Вторые, цитотоксические, препараты вызывают гибель клеток вследствие их интоксикации, разрушения оболочки и ядра клетки, других структур, и в конечном итоге некроз опухоли.
- Учитывая разные механизмы действия, в большинстве случаев онкологи подбирают комбинацию из двух-трех препаратов разных фармакологических групп.
- К лекарственному лечению онкологических заболеваний относят:
- Химиотерапию.
- Гормональную терапию.
- Иммунотерапию.
- Таргетную терапию.
- Фотодинамическую терапию.
Лекарственное лечение обычно проводится курсами.
Курс включает время введения препарата (от 1 до 5 дней для внутривенных препаратов, может быть дольше для таблетированных препаратов) и время перерыва для восстановления организма и снижения риска побочных эффектов лечения.
Перед началом каждого нового курса обычно производится контроль анализов крови и консультация врача онколога для решения вопроса о необходимости корректировки доз препаратов и/или увеличения интервала до следующего введения препарата.
Для длительного лекарственного лечения есть понятие «линий» лечения. «Линия» лечения – последовательное назначение одинаковых курсов химио- (или других видов) терапии.
«Линия» лечения проводится до достижения необходимого эффекта или до момента потери чувствительности со стороны болезни. Если опухоль продолжила расти на фоне одной схемы химиотерапии – производится смена лекарств.
Продолжение лечения с использованием новой схемы химиотерапии называется «Второй (третьей, четвёртой и т.д.) линией» лечения.
Химиотерапия
Химиотерапия – наиболее распространённый вид лекарственной терапии. Химиотерапия бывает:
1. Лечебной – когда химиотерапия является основным методом лечения заболевания.
Например, для многих пациентов с лейкозами, лимфомами, герминогенными опухолями яичка химиотерапия может быть основным методом лечения, который часто приводит к выздоровлению.
Для большинства пациентов с распространёнными формами рака, с метастазами в различные органы, химиотерапия является основным методом лечения, дающим максимальную возможность длительно сдерживать болезнь.
2. Неоадъювантной – когда химиотерапия предшествует основному методу лечения. Чаще всего такая химиотерапия назначается перед некоторыми видами операций, с целью уменьшения опухоли и снижения активности её клеток.
3. Адъювантной – её ещё называют «профилактической». Она назначается после основного метода лечения, чаще всего после операции, с целью снижения риска возврата болезни.
К наиболее распространённым противоопухолевым препаратам относят следующие группы:
- Алкилирующие антинеопластические препараты. Механизм их действия основан на внедрение алкильной группы препарата к ДНК раковой клетки: происходит нарушение структуры ДНК и она не может дальше делиться, запускается апоптоз. В эту группу входят: производные бис-B-хлорэтиламина — исторически первые цитостатические противоопухолевые средства; производные нитрозомочевины и препараты платин, содержащие двухвалентную платину.
- Алкилирующие триазины. Неклассические алкилирующие агенты, пролекарства, которые для проявления своей противоопухолевой активности должны пройти ряд метаболических превращений в организме, в результате которых образуются метилирующие агенты. Последние, внедряясь в ДНК и РНК раковой клетки, не позволяют ей дальше делиться.
- Антиметаболиты. Конкурентно вмешиваются в процесс деления клетки, вызывая ее апоптоз.
- Антрациклиновые антибиотики. Механизм их действия основан на цитотоксическом действии. Они ингибируют синтез ДНК, нарушают проницаемость клеточных мембран и другие механизмы жизнедеятельности клеток.
- Ингибиторы топоизомеразы I и топоизомеразы II, ингибиторы образования микротубул и ингибиторы веретена деления. Цитостатические препараты, избирательно нарушающие структуру ДНК и деление раковых клеток на разных этапах. Химиопрепараты в большинстве случаев вводятся внутривенно или перорально, тогда они оказывают системное воздействие на весь организм. Но могут быть использованы и местно, например, во время хирургической операции для обработки операционного поля, или регионарно, например, в желудочки головного мозга.
Гормональная терапия
Показана только для гормоночувствительных видов рака. Будет ли опухоль реагировать на лечение гормонами или нет, определят с помощью специальных анализов и лабораторных исследований клеточного материала, взятого из опухоли.
Опухоли, реагирующие на гормоны, часто обнаруживают в репродуктивной системе и железах внутренней секреции, например, это:
- рак молочной железы
- рак предстательной железы
- рак яичников
- рак эндометрия (рак тела матки).
Гормонотерапия может быть назначена до удаления опухоли с целью стабилизации ее роста или уменьшения размера, тогда она называется неоадъювантной. Или после — с целью предотвратить повторный рост или метастазирование, такую терапию называют адъювантной.
На поздних неоперабельных стадиях опухолей, чувствительных к данному лечению, гормональная терапия может использоваться в качестве основного лечения. Как паллиативное лечение некоторых видов рака она достаточно эффективна и может продлить жизнь пациента на 3-5 лет.
Иммунотерапия
Иммунитет играет важную роль в профилактике и борьбе с раком. В норме иммунные тельца распознают атипичную клетку и убивают ее, защищая организм от развития опухоли. Но когда иммунитет нарушается в силу разных причин, и раковых клеток становится много, тогда опухоль начинает расти.
Иммунотерапия при раке помогает организму справится с заболеванием за счет активизации защитных ресурсов и не допустить развития повторных опухолей и метастазов. В онкологии используют интерфероны, вакцины от рака, интерлейкины, колониестимулирующие факторы и другие иммунные препараты.
- Лечение подбирает иммунолог на основе лабораторных данных о состоянии иммунной системы онкопациента совместно с лечащим врачом-онкологом и другими специалистами, участвующими в лечении конкретного пациента.
- Основные механизмы иммунотерапии:
- подавление роста опухолевых клеток и их последующее уничтожение;
- профилактика рецидива опухоли и образования метастазов;
- уменьшения побочного влияния противоопухолевых средств, лучевой терапии;
- профилактика инфекционных осложнений при лечении опухолей.
Таргетная терапия
От английского target — цель, мишень. Относят к перспективным методам молекулярной медицины, будущему в лечении онкопатологий, как и разработку вакцин против рака.
Таргетные лекарства очень специфичны и разрабатываются под конкретный мутировавший ген раковой клетки данного вида опухоли. Поэтому до таргетного лечения обязательно проводят генетическое исследование материала, взятого на биопсию.
Например, разработаны эффективные таргетные препараты для лечения различных генетических форм рака молочной железы, множественной миеломы, лимфомы, рака предстательной железы, меланомы.
В силу своей специфики и целевого попадания на раковую клетку-мишень таргетные препараты более эффективны для лечения опухолей, чем например, классические противоопухолевые. И менее вредны для нормальных клеток, не обладающими характеристиками опухолевых. Многие таргетные методы относят к иммунотерапии, так как по сути они формируют нужный иммунный ответ.
Фотодинамическая терапия
Осуществляется препаратами, воздействуя световым потоком определённой длины волны на раковые клетки и разрушая их.
Побочные эффекты лекарственного лечения рака
Самое известное и пугающее онкопациентов осложнение после химиотерапии — выпадение волос. Происходит потому, что противоопухолевые препараты токсичны для молодых активно делящихся клеток, какими являются в том числе волосяные фолликулы и ногтевые пластины. На практике далеко не все виды химиотерапии вызывают выпадение волос.
Это осложнение характерно для узкого спектра препаратов, многие пациенты с ним не сталкиваются. На время действия препарата может снижаться активность обновляющихся клеток организма, из-за чего перестают расти ногти и волосы, происходит выпадение волос, угнетается система кроветворения.
После курса химиотерапии необходим восстановительный период, в течение которого организм приходит в норму.
- Выраженные осложнения наблюдаются далеко не у всех пациентов, но риск их возрастает с увеличением продолжительности лечения.
- Часто встречаются следующие побочные эффекты после проведения лекарственной терапии:
- выпадение волос, ломкость ногтей;
- тошнота, рвота;
- нарушение аппетита, изменение вкуса;
- анемия, кровотечение;
- нарушение иммунитета;
- диарея;
- бесплодие, нарушение сексуальной и репродуктивной сферы.
Большинство осложнений поддаётся корректировке, при правильном проведении лечения многие из них можно предотвратить или остановить при первом проявлении. Тяжёлые осложнения могут быть причиной увеличения интервалов между курсами химиотерапии.
Эффективность
Чем раньше обнаружен рак и точнее диагностирован тип опухолевых клеток, тем успешнее лечение рака и благоприятнее прогноз выздоровления.
Поэтому следует постоянно следить за состоянием своего здоровья, проходить диагностические исследования согласно возрасту, не закрывать глаза на недомогание или периодический дискомфорт в теле.
Также лучше не тратить время на попытки вылечиться самостоятельно или при помощи нетрадиционной медицины, не имеющей никаких убедительных данных об эффективности, игнорируя современные методы медицинского лечения.
Так можно только запустить онкологический процесс, усугубить стадию заболевания и затруднить последующее лечение. Не теряйте драгоценное время, обследуйтесь в специализированных центрах на современном оборудовании у высококвалифицированных врачей.
Противоопухолевые средства
- Описание
- Лечение онкологических заболеваний основывается на использовании трех основных методов — хирургическое вмешательство, лучевая терапия и фармакотерапия, либо их различных сочетаний.
- Противоопухолевые лекарственные средства разделяют на ряд групп, исходя из их химической структуры, источников получения, механизма действия: алкилирующие вещества, антиметаболиты, антибиотики, агонисты и антагонисты гормонов, алкалоиды и другие средства растительного происхождения, моноклональные антитела, ингибиторы протеинтирозинкиназы и другие.
Сравнительно недавно большое внимание стали привлекать эндогенные противоопухолевые соединения. Показана эффективность интерферонов и других лимфокинов (интерлейкинов — 1 и 2) при некоторых видах опухолей.
Наряду со специфическим тормозящим влиянием на опухоли, современные противоопухолевые средства действуют на другие ткани и системы организма, что, с одной стороны, обусловливает их нежелательные побочные эффекты, а с другой — позволяет использовать их в других областях медицины.
Одним из основных побочных эффектов противоопухолевой химиотерапии является угнетение кроветворения, что требует точного регулирования доз и режима применения препаратов; необходимо учитывать, что депрессия гемопоэза усиливается при комбинированной терапии — сочетании препаратов с лучевой терапией и др.
Часто наблюдаются тошнота, рвота, потеря аппетита, диарея, возможны алопеция и другие побочные явления. Некоторые противоопухолевые антибиотики обладают кардио- (доксорубицин и др.), нефро-, ото-, гепато- и нейротоксичностью. При применении отдельных препаратов возможно развитие гиперурикемии.
Эстрогены, андрогены, их аналоги и антагонисты могут вызывать гормональные расстройства.
Одной из характерных особенностей многих противоопухолевых препаратов является их иммуносупрессивное действие, сопровождающееся развитием инфекционных осложнений. В то же время ряд противоопухолевых средств (метотрексат, циклофосфамид, цитарабин и др.) используется как иммунодепрессанты при аутоиммунных заболеваниях.
Общими противопоказаниями к применению противоопухолевых препаратов являются выраженная лейко- и тромбоцитопения, тяжелая кахексия, терминальные стадии заболевания.
Вопрос об их использовании при беременности решается индивидуально.
Обычно, в связи с опасностью тератогенного действия, эти препараты при беременности не назначают, как и при кормлении грудью (следует прекратить грудное вскармливание).
Применяют противоопухолевые средства только по назначению врача-онколога. В зависимости от особенностей заболевания и его течения, эффективности и переносимости химиотерапии может меняться схема назначения, дозы, вводиться сочетание с другими препаратами и т.д.
Разработаны лекарственные методы повышения переносимости противоопухолевых препаратов. Так, высокоэффективные противорвотные средства (блокаторы серотониновых 5-НТ3-рецепторов: ондансетрон, трописетрон, гранисетрон и др.) позволяют уменьшить тошноту и рвоту, «колониестимулирующие факторы» (филграстим, молграмостим и др.) — снизить риск развития нейтропении.