То, как ребенок появляется на свет, — в ходе естественных родов или через кесарево сечение, — играет ключевую роль в формировании кишечного микробиома.
Новое (окей, осени 2019 года) исследование показало, что в кишечнике родившихся с помощью кесарева сечения младенцев отсутствуют штаммы кишечных бактерий (ну или их мало), обнаруженные у здоровых детей и взрослых. Вместо этого в их стуле обнаруживают бактерии, распространенные в больницах.
К такому выводу пришла группа ученых из Великобритании, проанализировав микробиомы почти 600 новорожденных! Несмотря на значительную разницу видового состава микробиомов сразу после рождения, пока не ясно, как это сказывается на здоровье в долгосрочной перспективе.
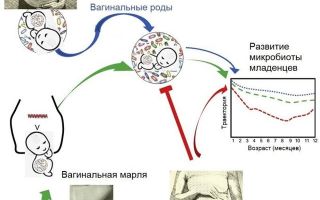
У детей, рожденных путем кесарева сечения, риск развития ожирения, астмы и других заболеваний несколько выше, чем у детей, рожденных вагинально. Такие результаты часто объясняют разницей в микробиомах. Эти наблюдения привели к тому, что некоторые родители и врачи пытаются восстановить «естественную» микробиоту младенцев, используя вагинальную жидкость [1] (рис. 1).
Однако не стоит считать такой подход странной выходкой аутсайдеров: споры о пользе этой процедуры ведутся давно в самых серьезных научных и медицинских кругах.
По крайней мере, четыре научные группы — в Соединенных Штатах, Швеции и Китае — проводят исследования на детях, родившихся путем кесарева сечения, в ходе которых они «подсаживают» младенцам микробов их матерей и сравнивают их с контрольной группой.
Каждая команда планирует наблюдать за участниками экспериментов в течение нескольких лет, чтобы понять, как микробы влияют на вес, риск развития аллергий и другие параметры [2]. Однако пока безопасность и эффективность данной процедуры не доказаны, ученые призывают родителей повременить с данной процедурой, дождаться результатов исследований, а с ними и, возможно, «работающего» варианта терапии.
Многочисленные вопросы — как способ рождения влияет на формирование микробиома и его видовой состав? какие долгосрочные эффекты он оказывает на формирование иммунной и нервной систем [3]? можно ли использовать пробиотики для восстановления здоровой микрофлоры? — стали причиной создания исследовательского проекта Baby Biome Study, в рамках которого и вышла обсуждаемая сегодня статья .
Группа Тревора Лоули работала с акушерками и врачами в трех больницах Лондона и в Лестере. Они отбирали пробы и анализировали ДНК микробов, обнаруженных в фекалиях 596 младенцев — 314-и, родившихся естественным путем, и 282-х, родившихся путем кесарева сечения, — через 4, 7 и 21 день после рождения.
В результате им удалось показать, что у детей, рожденных кесаревым сечением, отсутствуют штаммы комменсальных бактерий, которые обычно встречаются у здоровых людей и детей, родившихся вагинально (рис. 2).
Образцы от детей, родившихся естественным путем, были обогащены видами Bifidobacterium (такими как Bifidobacterium longum и Bifidobacterium breve), Escherichia (Escherichia coli), Bacteroides (Bacteroides vulgatus) и Parabacteroides (Parabacteroides distasonis).
Вместо них в кишечнике детей, родившихся с помощью кесарева сечения, преобладали оппортунистические бактерии, такие как Enterococcus и Klebsiella, часто циркулирующие в больницах (рис. 3). Разница в составе микробиомов младенцев была настолько значительной, что Лоули прокомментировал это так: «я могу взять образец кала у младенца и с высокой степенью уверенности сказать вам, как он родился» [6].
Рисунок 2. Средняя относительная численность родов бактерий, найденных в фекалиях младенцев, отобранных на 4, 7 и 21 сутки после рождения. Вагинальные роды: 744 образца от 310 младенцев. Роды через кесарево сечение: 725 образцов от 281 младенца.
Рисунок 3. Средняя относительная численность (слева) и частота (справа) шести видов условно патогенных бактерий в течение 21 дня жизни, обнаруженных в больших количествах у детей, родившихся с помощью кесарева сечения (голубой), по сравнению с детьми, родившимися вагинально (красный), и матерями (желтый)
Исследователи не остановились на выяснении различий в микробиомах новорожденных — они пошли дальше.
Оказалось, что спустя месяцы после рождения микробиомы младенцев становились всё более похожими, за исключением одного общего и очень важного рода комменсальных бактерий — Bacteroides.
Эти бактерии отсутствовали или присутствовали в очень малых количествах почти у всех детей после кесарева сечения. Девять месяцев спустя, в среднем, около 60% всех исследуемых детей всё еще имели мало или не имели вовсе этих бактерий в своем кишечнике.
Bacteroides — род грамотрицательных анаэробных палочковидных бактерий — ключевые члены кишечного микробиома человека. Предыдущие исследования показали, что некоторые виды бактероидов влияют на иммунную систему хозяев и помогают подавить воспаление [7].
Стоит также заметить, что частое и обильное ношение оппортунистических патогенов также наблюдалось у новорожденных, родившихся естественным путем и по тем или иным причинам имеющих низкий уровень бактероидов. А отсутствие грудного вскармливания в неонатальный период было связано с более высоким уровнем Clostridium perfringens, Klebsiella oxytoca и Enterococcus faecalis в кишечнике.
«Вероятно, существует множество факторов, помимо способа рождения, которые способствуют столь разительным различиям в микробиоме младенцев», — считает Джозеф Ной, неонатолог из Медицинского колледжа Университета Флориды в Гейнсвилле.
Антибиотики, которые обычно назначают до или во время операции, способны проникать через плаценту.
Рожденные кесаревым сечением дети, как правило, проводят в больнице больше времени после рождения и начинают получать грудное молоко, содержащее полезные бактерии, позже, чем дети, родившиеся естественным путем, — а это тоже важный фактор становления иммунитета [8].
- Ewen Callaway. (2016). Scientists swab C-section babies with mothers' microbes. Nature;
- Sara Reardon. (2019). Do C-section babies need mum’s microbes? Trials tackle controversial idea. Nature. 572, 423-424;
- Peter Andrey Smith. (2015). The tantalizing links between gut microbes and the brain. Nature. 526, 312-314;
- Новые функции кишечной микрофлоры;
- Микробиом кишечника: мир внутри нас;
- Yan Shao, Samuel C. Forster, Evdokia Tsaliki, Kevin Vervier, Angela Strang, et. al.. (2019). Stunted microbiota and opportunistic pathogen colonization in caesarean-section birth. Nature. 574, 117-121;
- H. M. Wexler. (2007). Bacteroides: the Good, the Bad, and the Nitty-Gritty. Clinical Microbiology Reviews. 20, 593-621;
- Чем новорожденные обязаны рецептору CCR10.
Кесарево сечение снабдило младенцев патогенами вместо материнских бактерий
National Library of Medicine
Британские и австралийские медики выяснили, что микробиом младенцев существенно различается в зависимости от того, появились они на свет естественным путем или в результате кесарева сечения.
Первые чаще получали бактерии от матери, а у вторых существенную часть микробиоты составляли патогенные виды бактерий, характерные для больничных помещений. Впрочем, через месяц после родов состав микробиома у обеих групп значительно выровнялся.
Исследование опубликовано в журнале Nature.
Несмотря на то, что с некоторыми бактериями ребенок встречается еще в материнской утробе, бóльшая часть микробиоты заселяет его организм во время родов и сразу после них.
Поскольку микрофлора отвечает за самые разные аспекты здоровья — от обмена веществ до работы иммунной системы — для последующей жизни ребенка крайне важно самое раннее воздействие бактерий во время появления на свет, грудного вскармливания или применения антибиотиков.
Ян Шао (Yan Shao) из института Wellcome Sanger вместе с коллегами из Великобритании и Австралии исследовали микробиом новорожденных в рамках проекта Baby Biome Study. Ученые проанализировали бактериальный состав в кишечнике 314 младенцев, которые появились на свет естественным путем, и еще 282, которые родились с помощью кесарева сечения.
Исследователи обнаружили, что способ появления на свет влияет на видовой состав кишечных бактерий гораздо сильнее, чем способ вскармливания (грудное молоко или смесь) или применение антибиотиков.
У тех, кто родился естественным путем, преобладали представители родов Bifidobacterium и Bacteroidetes, а также кишечная палочка Escherichia coli — они составляли 68,3 процента всего микробиома.
У тех же, кто появился на свет с помощью кесарева сечения, этих бактерий было меньше, а вместо них кишечник заселили характерные представители энтерококков, стафилококков и клостридий, которые нередко становятся причиной внутрибольничных инфекций.
Состав микробиома у детей, которые появились на свет вагинальным путем (слева) или с помощью кесарева сечения (справа). Вначале набор бактерий различается сильно, а к первому месяцу жизни выравнивается.
Shao et al. / Nature (2019)
Затем ученые сравнили микрофлору 175 пар ребенка и матери, чтобы выяснить, какие виды передаются при родах напрямую. Оказалось, что при естественных родах бактерии переходят от матери к ребенку в 74 процентах случаев, а при кесаревом сечении — всего в 12 процентах. При этом мать, как правило, снабжает ребенка здоровой микробиотой (кишечной палочкой и бифидобактериями), а патогены, судя по всему, приходят из больничного окружения.
Таким образом, исследователи продемонстрировали, что при кесаревом сечении нарушается передача микробиоты от матери к ребенку. Тем не менее, уже через месяц после родов микробиом таких детей стал похож на здоровый.
Поэтому, заключают авторы работы, чтобы сделать однозначные выводы о том, как способ рождения влияет на здоровье ребенка, необходимы долгосрочные исследования, в том числе и с участием детей, которые появились на свет в результате домашних родов.
Ранее ученые уже обнаруживали связь между кесаревым сечением и развитием заболеваний: например, у детей, рожденных таким способом, чаще диагностировали ожирение и астму. Связано ли это с микробиотой, однако, не ясно.
Примечание: изначально в заметке была допущена неточность, не все энтерококки и клостридии вызывают больничные инфекции, а только некоторые их представители — те, которых обнаружили в кишечнике младенцев после кесарева сечения. Приносим свои извинения читателям.
Полина Лосева
Полезные бактерии могут быть восстановлены у детей с кесаревым сечением при рождении
19.06.2021 13:17
У детей, рожденных путем кесарева сечения, нет таких же здоровых бактерий, как у тех, кто родился вагинально, но исследование, проведенное в университете Рутгерса (Rutgers University) впервые показало, что эти естественные бактерии могут быть восстановлены.
Человеческая микробиота состоит из триллионов бактерий, вирусов, грибов и других микроорганизмов — некоторых полезных, а некоторых вредных, — которые обитают в нашем организме и на нем.
Женщины естественным образом снабжают этими первопроходцами стерильные тела своих младенцев во время схваток и родов, помогая развиваться их иммунной системе.
Но антибиотики и кесарево сечение мешают прохождению микробов и связаны с повышенным риском ожирения, астмы и нарушений обмена веществ в будущем.
Исследователи наблюдали за 177 младенцами из четырех стран в течение первого года их жизни — 98 родились вагинально и 79 родились посредством кесарева сечения, 30 из которых были тампированы материнской вагинальной марлей сразу после рождения.
Лабораторный анализ показал, что микробиота детей с кесаревым сечением, взятых с вагинальными жидкостями их матери, была близка к микробиоте младенцев, рожденных естественным путем.
Кроме того, микробиомы влагалища матери в день рождения были аналогичны микробиомам других частей их тела (кишечника, рта и кожи), что свидетельствует о том, что влагалищные жидкости матери помогают колонизировать бактерии на теле их детей.
Это было первое крупное обсервационное исследование, которое показало, что восстановление естественного контакта ребенка с кесаревым сечением с материнскими вагинальными микробами при рождении нормализует развитие микробиома в течение первого года его жизни. Исследователи заявили, что следующим шагом будет проведение рандомизированных клинических испытаний, чтобы определить, способствует ли нормализация микробиоты защите от болезней.
«Необходимы дальнейшие исследования, чтобы определить, какие бактерии защищают от ожирения, астмы и аллергии, заболеваний, в основе которых лежит воспаление», — сказала старший автор исследования Мария Глория Домингес Белло (Maria Gloria Dominguez Bello), профессор кафедры биохимии и микробиологии Школы экологических и биологических наук в университете Рутгерса (штат Нью-Брансуик). «Наши результаты подтверждают гипотезу о том, что приобретение материнских вагинальных микробов нормализует развитие микробиома у младенцев».
- По данным Всемирной организации здравоохранения, кесарево сечение необходимо примерно в 15 процентах родов, чтобы избежать риска для жизни матери или ребенка, но во многих странах, таких как Бразилия, Доминиканская Республика, Иран и Китай, кесарево сечение проводится более чем в 70% городских родов.
- Источник: Материал предоставлен Rutgers University
- Краткая выдержка по теме исследования из статьи в журнале Med
Натурализация траектории развития микробиоты новорожденных, рожденных кесаревым сечением, после вагинального посева
- Se Jin Song, Maria Gloria Dominguez-Bello, et al.
- Naturalization of the microbiota developmental trajectory of Cesarean-born neonates after vaginal seeding
- Med, June 17, 2021
- Особенности
- Вагинальный посев новорожденных, рожденных после кесарева сечения, натурализует их микробиоту
- Бактерии из разных частей тела составляют перинатальный микробиом влагалища матери.
- Бактерии, типичные для вагинальных родов, приживаются на разных участках новорожденных, рожденных после кесарева сечения
Контекст и значение
Рождение путем кесарева сечения изменяет микробиоту младенцев и связано с повышенным риском иммунных и метаболических нарушений.
Мы восстановили естественное микробное воздействие на младенцев жидкостей родовых путей их матерей сразу после рождения кесаревым сечением и обнаружили, что перинатально материнский родовой путь содержит очень высокие доли бактерий, характерных для других участков тела, и что приживление этих материнских бактерий нормализует развитие микробиоты в различных участках тела ребенка. В контексте рисков и преимуществ процедур кесарева сечения нормализация микробиоты младенцев с рождения может смягчить побочные эффекты отсутствия колонизации важными ранними бактериями и снизить повышенный риск иммунных и метаболических заболеваний, связанных с рождением путем кесарева сечения.
Резюме
Ранние нарушения микробиоты связаны с нарушениями, которые связаны с иммунологической подоплекой.
У младенцев, родившихся после кесарева сечения (КС), наблюдается изменение развития микробиоты по сравнению с младенцами, рожденными естественным путем.
Здесь мы представляем первое статистически обоснованное продольное исследование для определения эффекта восстановления воздействия материнских вагинальных жидкостей после рождения КС.
- Методы
- Используя секвенирование гена 16S рРНК, мы проследили микробные траектории множественных участков тела у 177 младенцев в течение первого года жизни; 98 родились вагинально, 79 родились от КС, 30 из которых были тампированы материнской вагинальной марлей сразу после рождения.
- Полученные данные
Композиционный тензорный факторизационный анализ подтвердил, что траектории микробиоты детей, рожденных с помощью КС и подвергшихся воздействию тампированию, более точно совпадали с таковыми у детей, рожденных естественным путем.
Интересно, что большинство вариантов последовательности ампликона из микробиомов влагалища матери в день рождения были общими с другими материнскими участками, в отличие от небеременных женщин из исследования Human Microbiome Project (HMP).
Выводы
Результаты этого наблюдательного исследования побуждают к срочным рандомизированным клиническим испытаниям, чтобы проверить, снижает ли микробное восстановление повышенный риск заболевания, связанный с рождением КС, и лежащие в его основе механизмы.
Это также свидетельствует о плюрипотентной природе материнских вагинальных жидкостей, которые обеспечивают первопроходческие бактериальные колонизаторы для участков тела новорожденного.
Это первое исследование, показывающее долгосрочную натурализацию микробиоты новорожденных с КС путем восстановления микробного воздействия при рождении.
Дополнительно см.: Пробиотическая смесь устраняет вредные последствия у детей, получавших антибиотики или рожденных путем кесарева сечения
К разделу: Пробиотики при беременности и после родов
Пожалуйста, авторизуйтесь, чтобы оставить комментарий.
Я согласен(на) на обработку моих персональных данных. Подробнее
Кесарево сечение влияет на кишечную микробиоту ребенка
У детей, рожденных от кесарева сечения, в кишечнике больше потенциально инфекционных бактерий, — пишет sciencenews.org со ссылкой на «Nature».
Дети, рожденные с помощью кесарева сечения, могут недополучить многие полезные кишечные микробы мамы. Ученые обнаружили, что вместо этого кишечники этих младенцев содержат больше бактерий, которые обычно прячутся в больничных палатах.
Открытие подтверждает уже полученную ранее информацию о том, что кесарево сечение и антибиотики, которые часто применяются при процедуре, могут изменить тип бактерий, которые поселяются в кишечнике новорожденного. Некоторые ученые предполагают, что эта коллекция микробов помогает формировать микробиом, и детали этой ранней колонизации могут быть важны для долгосрочного здоровья.
Тем не менее, женщины, которым необходимо кесарево сечение по показаниям, не должны отказываться от этого способа.
«Кесарево сечение является жизненно необходимым и необходимым с медицинской точки зрения вмешательством, — говорит Лиза Стинсон, молекулярный микробиолог и репродуктивный биолог из Университета Западной Австралии в Перте. — Но «нам нужно лучше понять его долгосрочные последствия для детей».
Дисбаланс микробиомов связан с такими расстройствами, как астма, аллергия и другие воспалительные заболевания. Но ученые не знают, может ли зарождающийся микробиом ребенка в конечном итоге повлиять на эти нарушения. Также не ясно, изменяют ли детали рождения эту раннюю микробную колонизацию.
Чтобы получить снимок ранней микробиоты, геномист Ян Шао из Wellcome Sanger Institute в Кембридже (Англия), и его коллеги изучили кишечные бактерии, живущие в кишечниках 596 доношенных здоровых детей, родившихся в больницах Великобритании.
У 314 детей, рожденных традиционно, полезные микробы кишечника, такие как Bifidobacterium и Bacteroides, составляли в среднем 68 процентов от общего числа кишечных бактерий. Эти бактерии были редки в кишечниках детей, рожденных с помощью кесарева сечения.
Вместо этого виды, обычно встречающиеся в больничных учреждениях, включая потенциально вредные энтерококки и клостридии, составляли в среднем 68 процентов от общего числа кишечных бактерий.
Удивительно, но ни в одной группе детей не было большого количества бактерий из влагалища их матерей, и это отсутствие ставит под сомнение целесообразность доставки влагалищных микробов новорожденным.
Омывание влагалищными жидкостями детей, рожденных с помощью кесарева сечения, использовалось как способ восстановления нормальной микробиоты кишечника.
Но новое исследование не нашло никаких доказательств в поддержку этой противоречивой практики.
Исследование показало, что наряду с самой формой рождения антибиотики, доставляемые во время родов, также определяют, какие бактерии развиваются в кишечнике ребенка. Во многих местах матери, которые подвергаются кесареву сечению, получают антибиотики для предотвращения инфекций.
Наряду с устранением потенциальных угроз, эти препараты могут убивать полезные бактерии. В исследовании дети, родившиеся вагинально, но чьи матери также принимали антибиотики, имели меньше полезных бактерий Bacteroides.
Это говорит о том, что некоторые из бактериальных различий «связаны с воздействием антибиотиков у матери, а не с отсутствием контакта с вагинальными бактериями при рождении», говорит Стинсон.
По словам Стинсона, антибиотики также могут влиять на микробный состав в материнском грудном молоке, который может изменять микробиом кишечника ребенка. В исследовании грудное вскармливание оказало небольшое влияние на кишечные бактерии у детей.
По мере того, как дети становились старше и начинали есть твердую пищу, различия в составе кишечных бактерий сокращались, обнаружили исследователи, проанализировав меньшую группу детей.
Во время исследования все дети были здоровы. Неизвестно, могут ли бактерии, которые потенциально могут вызвать инфекцию у этих детей, привести к проблемам в дальнейшей жизни. Несмотря на это, начало жизни с неправильным набором микробов, вероятно, имеет последствия, — говорит микробиолог Мария Домингес-Белло из Университета Рутгерса в Нью-Брансуике (штат Нью-Джерси).
[ sciencenews.org]
Нарушения кишечной микробиоты у детей, рожденных путем кесарева сечения
Специалисты ФГБУ «НМИЦ АГП им. В.И. Кулакова» МЗ РФ и ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» МЗ РФ представили обзор научной литературы, посвященной изучению краткосрочных и долгосрочных последствий операции кесарева сечения (КС) для здоровья ребенка.
Дети, рожденные путем КС, испытывают влияние различных физических, гормональных, бактериальных и медицинских воздействий в интранатальном и раннем постнатальном периоде. Они нередко подвергаются воздействию антибактериальных препаратов как до рождения, так и после.
Во время КС отсутствуют воздействия механических сил и гормонов стресса, которые наблюдаются при естественных родах и дают важные сигналы ребенку для его подготовки и приспособления к внеутробной жизни.
У младенцев, рожденных путем КС, отсутствие необходимых триггеров во время рождения может дополнительно усугубляться более короткой беременностью, связанной с плановым КС ранее 40 нед.
Не менее опасны и неблагоприятные отдаленные последствия КС.
Различные исследования выявляют связь между рождением путем КС и многочисленной патологией: желудочно-кишечными болезнями, ожирением, повышением артериального давления, метаболическим синдромом, астмой, инфекциями дыхательных путей, изменениями функции печени, аутоиммунными заболеваниями, сахарным диабетом 1-го типа и неврологическими проблемами.
Значимым механизмом формирования неблагоприятных последствий КС может быть изначально нарушенное становление микробиома у ребенка вследствие рождения путем КС. Самый густонаселенный микроорганизмами орган у человека — желудочно-кишечный тракт.
У взрослого человека обитает около 100 трлн кишечных бактерий, которые превосходят количество соматических клеток в соотношении 1,3:1. Кишечный микробиом обладает огромным разнообразием, включая более 1000 различных видов и около 160 видов на образец кала.
Кишечный микробиом содержит примерно в 25 раз больше генов, чем геном человека.
Человеческий микробиом стал предметом особого интереса, и за последние два десятилетия многочисленные исследования показали его влияние как на наше настоящее здоровье, так и на формирование будущего здоровья у детей.
Нарушение микробного баланса может вызывать широкий спектр иммуноопосредованных нарушений: воспалительных заболеваний кишечника, аутоиммунных и аллергических заболеваний.
Кроме того, имеются данные, свидетельствующие о влиянии микробиоты кишечника на поведение, связанное со стрессом, включая тревогу и депрессию, а также на развитие психоневрологических расстройств.
Учитывая, что микробиота кишечника имеет большое значение в развитии метаболизма и иммунной системы детей, в настоящее время растет доказательство важности правильного становления ранней микробиоты кишечника для формирования здоровья ребенка в будущем.
К настоящему времени известно, что внутриматочная среда нестерильна. Микробная ДНК обнаруживается в плаценте, околоплодных водах и меконии.
Однако количество микроорганизмов, полученных ребенком внутриматочно, невелико и, по-видимому, обнаруженные бактерии нежизнеспособны для создания микробиоты кишечника ребенка.
Кроме того, важные для первоначального заселения кишечника бактерии (лакто- и бифидобактерии) в пренатальных нишах встречаются редко. В связи с этим большую важность для становления кишечного микробиоценоза приобретает вертикальная передача микрофлоры от матери ребенку в процессе родов.
Состав бактерий, с которыми первоначально сталкивается младенец, родившийся естественным путем, сильно отличается от такового при КС.
При этом ситуация еще может ухудшаться более частым применением антибиотиков при КС. Дети, рожденные естественным путем, преимущественно получают бактерии из влагалища и перианальной зоны матери.
При КС дети заселяются преимущественно бактериями материнской кожи и окружающей среды больницы.
Авторы обращают внимание на общее снижение разнообразия кишечного микробиома и на меньшее количество Bacteroides у детей, родившихся путем КС.
Также в подавляющем большинстве исследований было обнаружено доминирование и значительно большее разнообразие Actinobacteria, таких как Bifidobacteria, у детей, рожденных естественным путем, и лишь единичные исследования не смогли это продемонстрировать.
Противоречивые результаты получены в отношении количества Lactobacillus и Enterobacteriaceae при разных способах родоразрешения.
Имеются работы, показавшие, что у детей, родившихся через естественные родовые пути, большее количество Lactobacillus, Pectobacterium и Prevotella по сравнению с детьми, родившимися с помощью КС.
Многими авторами обнаружено, что Lactobacillus значительно чаще встречаются при родоразрешении через естественные родовые пути.
Однако есть работы, в которых не удалось установить зависимость состава Firmicutes (таких как Clostridium perfringens, Enterococcus- и Lactobacillus-подобных бактерий) от способа родоразрешения.
Напротив, когортное исследование новорожденных, проведенное в 3 европейских странах, а также в Индии, подтвердило высокую распространенность Clostridia у детей, рожденных путем КС, по сравнению с родившимися естественным путем. В работе японских авторов также обнаружено, что дети, рожденные с помощью КС, имеют значительно более высокое носительство альфа-токсигенных Clostridium perfringens, а кишечное представительство группы B. fragilis и бифидобактерий у них снижено. При этом обращается внимание, что эти изменения проявляются не ранее чем через 1 нед после рождения.
- Akagawa и соавт. продемонстрировали большее количество Bacteroidesи Enterobacterialesу детей после рождения через естественные родовые пути, в то время как у детей после КС преобладали Streptococcus. Стрептококки в основном относятся к микрофлоре кожи, носовой и ротовой полости, что подтверждает факт формирования микробиоты кишечника детей, рожденных путем КС, из этих локусов тела и из больничной среды.
При изучении взаимосвязи кишечной микробиоты со способом родоразрешения важно учитывать возраст ребенка, так как различия могут недостаточно проявляться на мекониевой стадии, но становятся более заметными впоследствии.
В то же время в одном из исследований авторы описали различия микробиоты мекония в зависимости от способа родоразрешения, которые заключались в более редком выявлении бактерий рода Lactobacillus (особенно подгруппы L.
gasseri) у детей, рожденных путем КС.
В настоящее время точно не известно, как долго сохраняются изменения микробиоты кишечника после КС, но есть свидетельства о том, что, возможно, они могут сохраняться и до взрослой жизни. Так, в некоторых работах обнаружили дисбаланс микрофлоры, связанный с КС, у 6-месячных младенцев.
В других исследованиях обращалось внимание на недостаточное количество Bacteroides в течение первого года жизни у младенцев, рожденных путем КС. Более низкое общее микробное разнообразие у детей после КС отмечалось в течение первых 2 лет жизни.
Ряд авторов свидетельствуют, что различия в кишечной микробиоте постепенно исчезают к 3 годам, в то время как в других работах выявлено персистирование нарушений микробиоты до 7 лет.
А японские авторы обнаружили, что как у младенцев, так и у молодых взрослых субъектов в группе КС наблюдается значительно более низкая частота носительства B. fragilis и L. sakei по сравнению с группой родившихся естественным путем.
По-видимому, достаточно длительные изменения ранней микрофлоры кишечника у детей, рожденных путем КС, могут вносить свою отрицательную роль в развитие ряда заболеваний в будущем.
Известно, что бактерии участвуют в созревании и регуляции иммунной системы, влияя на уровень естественных киллеров, популяцию Т-лимфоцитов, секрецию IgA и синтез провоспалительных цитокинов. Например, B.
fragilis имеет значимое воздействие на иммунную систему, и ее низкое представительство в микробиоте детей после КС может неблагоприятно сказываться на формирование иммунной защиты.
Виды Bifidobacterium способны предотвращать некротизирующий энтероколит, участвовать в регуляции массы тела младенцев, а Lactobacillus уменьшают гиперреактивность дыхательных путей, ограничивая присутствие воспалительных клеток в перибронхиальной ткани. У детей, рожденных путем КС, в совокупности отмечены отложенная колонизация бактерий типа Bacteroides, низкое бактериальное разнообразие и снижение ответов Th1 в течение первых 2 лет жизни, что может иметь связь с повышенным риском развития аллергических заболеваний.
Снижение видового состава микроорганизмов приводит к изменению содержания метаболитов в сыворотке и стуле у младенцев после КС. Дети, рожденные путем КС, имеют значительно более низкий уровень короткоцепочечных жирных кислот в фекалиях и, следовательно, более высокий pH стула, что связано с более низким содержанием B.
fragilis, лактобацилл и бифидобактерий, которые вырабатывают короткоцепочечные жирные кислоты и поддерживают более низкий уровень pH в кишечнике, что в конечном итоге сдерживает рост условно-патогенных микроорганизмов, в том числе токсигенных C. рerfringens.
Таким образом, нарушение становления кишечной микрофлоры у детей, рожденных путем КС, может приводить к повышенному риску кишечных инфекций.
Также отмечены относительно более низкие уровни пропионата в кале у младенцев и у молодых взрослых субъектов, рожденных путем КС, что может быть связано со снижением распространенности Bacteroides, которые продуцируют пропионат. Интересно, что и бактероиды, и пропионат были вовлечены в отдельных исследованиях в риск развития ожирения.
В настоящее время широко известна концепция существования оси «кишечник-мозг», т.е. двунаправленного канала коммуникаций между центральной нервной системой и кишечником.
Этот комплекс коммуникаций обеспечивает как координацию желудочно-кишечных функций, так и обратное влияние последних на центральную нервную систему.
Микробиота кишечника в настоящее время рассматривается как неотъемлемый участник этих связей, влияющий на обе системы.
Учитывая значимое влияние ранней микробиоты на здоровье будущего поколения, обсуждаются различные технологии, которые могли бы нивелировать неблагоприятные эффекты КС на микробиоту кишечника младенцев.
Одним из предложенных методов является вагинальный посев, который рассматривается как потенциальный способ колонизировать младенцев микрофлорой, которую они получили бы при вагинальных родах. Вагинальный посев предполагает обеспечение контакта новорожденного с материнской вагинальной микробиотой сразу после рождения.
Для этого может использоваться накожное нанесение марли, предварительно инкубированной во влагалище матери, или пероральное введение материнской микробиоты, полученной перед рождением ребенка.
Эффективность влагалищного посева еще недостаточно изучена, и высказываются опасения в отношении возможности ятрогенного инфицирования ребенка, поэтому применение данного метода требует исключения заражения ребенка инфекциями, передающимися интранатально (стрептококком группы В, вирусом простого герпеса и др.).
Альтернативным способом улучшения микробиома кишечника новорожденных после КС может стать организация правильного вскармливания. Питание новорожденных и детей грудного возраста является крайне важным фактором, влияющим на микробиоту, а прекращение грудного вскармливания вносит вклад в наиболее фундаментальный сдвиг в составе бактерий.
В женском молоке насчитывается более 200 различных видов бактерий с большими индивидуальными вариациями, при этом в 1 л молока содержится 109 микроорганизмов. В период грудного вскармливания кишечник ребенка колонизируется представителями Actinobacteria и Firmicutes. Актинобактерии представлены в основном Bifidobacterium: B.
breve, B. longum, B. dentium, B. infantis и B. pseudoca-tenulatum; к основным лактобациллам относятся L. fer-mentum, L. gasseri, L. rhamnosus, L. acidophilus, L. salivarius, L. lactis и L. reuteri.
В образцах грудного молока из Германии и у австрийских матерей лактобактерии обнаруживались чаще, чем бифидобактерии, при этом одним из наиболее распространенных видов являлась L. fermentum.
Помимо бактерий, грудное молоко характеризуется уникальным составом олигосахаридов, а также многими антимикробными факторами, такими как лизоцим, лактоферрин, секреторный иммуноглобулин А, которые обеспечивают дополнительную селекцию кишечного микробиома младенцев.
Насколько грудное вскармливание может исправить микробный дисбаланс после КС, точно неизвестно. С одной стороны, обнаружено, что в возрасте 1 мес дети, рожденные вагинальным путем, все еще имеют более высокую долю Bacteroides независимо от типа кормления.
С другой стороны, показано, что даже неполное кормление грудным молоком уменьшает выраженность дисбиотических изменений кишечника у новорожденных.
Однако авторы еще одной работы обращают внимание на то, что, в отличие от исключительно грудного вскармливания, введение смеси приводит к сохранению изменений микробиома в возрасте 6 нед, что, с точки зрения исследователей, предлагает новые доказательства в поддержку принципов инициативы Всемирной организации здравоохранения и необходимости применения докорма детскими молочными смесями исключительно по медицинским показаниям.
Возможным и потенциально эффективным способом улучшения микробиоты кишечника ребенка после КС является использование добавок пребиотиков и пробиотиков, что особенно актуально при искусственном вскармливании.
Пребиотики определяются как неперевариваемые пищевые вещества, приносящие пользу макроорганизму, способствуя росту полезных кишечных бактерий.
Пребиотики включают олигосахариды, пищевые волокна и другие неперевариваемые углеводы.
В настоящее время многие молочные смеси дополняются пребиотиками, такими как короткоцепочечные галакто-олигосахариды и длинноцепочечные фруктоолигосахариды, которые увеличивают общее представительство Bifidobacterium в микробиоме младенцев и, подобно грудному молоку, способствуют преобладанию лактата и короткоцепочечных жирных кислот в кишечнике. Существуют многообещающие результаты исследований, в которых отмечено увеличение мягкости стула, улучшение состава микробиоты кишечника, усиление иммунной защиты, снижение частоты кишечных и респираторных инфекций при использовании молочных смесей с пребиотиками.
Положительные эффекты применения пробиотиков включают: а) улучшение состава кишечной микрофлоры; б) сохранение его устойчивости; в) конкуренцию с патогенами за питательные вещества и адгезию; г) укрепление барьера слизистой оболочки кишечника; д) противовоспалительное действие; е) модуляцию иммунной системы.
Изучают эффекты различных добавок пробиотиков для детей первого года жизни: Bifidobacterium infantis, Lactobacillus rhamnosus GG, Bifidobacterium breve Bb12, Lactobacillus reuteri, Lactobacillus fermentum.
Учитывая синергизм благоприятного влияния пребиотиков и пробиотиков, они названы синбиотиками, и применение их в комбинации будет увеличивать выживаемость полезных бактерий, улучшать состояние микробиоты и функций желудочно-кишечного тракта. Так, наличие в детских молочных смесях комбинации олигосахаридов и L. fermentum будет усиливать положительные эффекты обеих добавок.
Конечно, к настоящему времени еще далеко не все вопросы, касающиеся особенностей становления микробиоты младенцев, рожденных путем КС, раскрыты. Еще недостаточно данных о выборе оптимальных пре- и пробиотиков, их дозы и продолжительности применения.
Требуется больше исследований, направленных на изучение формирования будущего здоровья новорожденных, в том числе их когнитивных функций, частоты атопических и воспалительных реакций, особенностей иммунитета в зависимости от выраженности раннего дисбиоза кишечника и методов его коррекции.
Естественными и наилучшими факторами для развития ребенка являются рождение через естественные родовые пути и последующее грудное вскармливание, которые в самом раннем возрасте обеспечивают формирование оптимального микробиома.
Важность именно этого раннего периода формирования здоровья подчеркивается широко известной концепцией «первых 1000 дней» — периода от зачатия до 2 лет.
Первые 1000 дней представляют собой уникальное окно чувствительности, в котором окружающая среда во всех ее формах создает отметки в геноме, программируя здоровье и будущий риск заболеваний человека на всю жизнь.
Следовательно, понимание, как формируется кишечное микробное сообщество, в это время имеет большое значение. И именно первые 1000 дней жизни могут представлять собой окно возможностей для использования эффективных интервенций, направленных на улучшение состояния здоровья детей в будущем.
Улучшение кишечной микробиоты детей, родившихся путем КС, — очень важная стратегия, которая будет определять формирование будущего здоровья ребенка.
Безусловно, всеми мерами необходимо поддерживать исключительно грудное вскармливание в этой группе младенцев.
К сожалению, по ряду причин грудное вскармливание не всегда возможно, и в этих случаях, как показывают научные исследования, приоритет будет иметь применение детских питательных смесей с синбиотиками.
Источник:
Нароган М.В. Нарушения кишечной микробиоты у детей, рожденных путем кесарева сечения, и возможности их коррекции // Неонатология: новости, мнения, обучение. 2021. Т. 9, № 2. С. 24-32.