Одна из самых секретных разработок российской медицины попала в неприятную историю, которая могла бы так и остаться в стенах петербургской лаборатории. Рассказываем, как российские учёные изобретали молекулу для лечения меланомы и рака лёгких и с какими трудностями столкнулись.
В ноябре 2018 года состоялся XXII Российский онкологический конгресс. Представители фармзавода «Биокад» и врачи рассказали об успешных испытаниях на людях новейшего отечественного лекарства от рака. Он заставляет иммунные клетки атаковать опухоль.
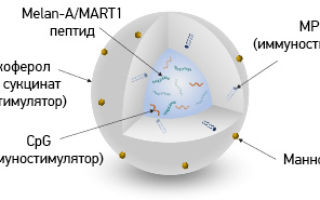
Речь о препарате под кодовым названием BCD-100. Это одна из самых засекреченных разработок отечественной фармацевтики — не разглашают даже имена учёных, разработавших молекулу (основное действующее вещество).
Препарат показал ошеломляющие результаты в лечении неоперабельной меланомы. Когда опухоль даёт метастазы, зловредные клетки проникают в окружающие органы и там формируют вторичные очаги болезни. Справиться с метастазирующей меланомой гораздо труднее.
Однако BCD-100 сумел полностью убрать подобные опухоли у 7% пациентов. Ещё у 29% пациентов размер опухоли уменьшился не меньше чем на треть. В исследовании участвовало 126 онкобольных с неоперабельной меланомой.
Испытания финансировал сам «Биокад».
Не самый частый, но один из самых агрессивных видов рака (≈74 тысяч больных в РФ). С 1950-х мировая заболеваемость выросла на 600%
Однако пациентов ждут серьёзные побочные эффекты, которые стали сюрпризом и для врачей — препарат-то новый.
«Внедрение [иммунотерапии], по-русски сказать, взорвало химиотерапевтам мозг. Мы столкнулись со спектром сложных и не понятных для нас [побочных] реакций. Может поражаться любой орган: начиная от щитовидной железы и заканчивая воспалением сосудов».
онколог центра им. Блохина Михаил Федянин
Но в декабре 2018 года НИИ онкологии им. Н.Н.Петрова (Санкт-Петербург) презентовал новые данные о результатах того же исследования.
У пациентов, принимавших BCD-100, чаще воспалялась щитовидная железа, чем у пациентов, принимающих аналогичные зарубежные препараты. Об этом заявил на конференции Федянин, то же впоследствии подтвердил и химиотерапевт из НИИ онкологии им. Н.Н.
Петрова Алексей Новик. Его выступление находится в открытом доступе. Однако другие показатели побочных явлений не сильно отличались от уже выпущенных на рынок аналогов, так что Новик осторожно назвал BCD-100 «не менее безопасным», чем ему подобные.
В ноябрьском выступлении доктор Федянин коротко обмолвился: были описаны смертельные случаи после приёма подобных препаратов. Одна из причин летальности — воспаление сердечной мышцы (миокардит).
Ни Федянин, ни Новик подолгу не останавливались на опасностях подобного рода препаратов. Врачи не упомянули и о смертельном случае с одним из пациентов-добровольцев. А самое главное, этого не сделала медицинский директор фармзавода «Биокад» Юлия Линькова.
Представители завода «Биокад» вовремя не проинформировали государственные службы о смерти пациента из-за приёма BCD-100. Об этом говорится в материалах проверки Росздравнадзора, которые попали в Лайф из прокуратуры.
«В ходе клинического исследования препарата BCD-100 по протоколу Miraculum уполномоченное лицо ЗАО «Биокад» Юлия Линькова [не сообщила] в Росздравнадзор о летальной непредвиденной нежелательной реакции на данный препарат».
Материалы проверки Росздравнадзора от 26.11.18
Линькова обязана была уведомить о произошедшем либо через защищённую информационную систему Росздравнадзора, либо просто по электронной почте.
В том же предписании Росздравнадзор отмечает, что ни в 2017-м, ни в 2018-м в адрес ведомства вообще не поступало данных о безопасности трёх других препаратов, которые разрабатывает «Биокад».
© Генпрокуратура РФ
Недавние исследования показали — больше половины российских медиков не сообщают в Росздравнадзор о побочных эффектах на препараты, с которыми столкнулись их пациенты. Ещё 8% вообще считают, что рассказывать о нежелательных реакциях нецелесообразно.
Ещё в 2016 году министр здравоохранения Вероника Скворцова назвала результаты использования BCD-100 фантастическими. Протоколу, по которому исследовали лекарство, даже придумали соответствующее метафорическое название. С латыни «miraculum» переводится как «чудо«. И действительно, с некоторыми пациентами BCD-100 сотворил чудо.
У 64-летней пациентки из Питера был опухолевый очаг в лёгком
Через несколько месяцев после приёма BCD-100 опухоль заметно уменьшилась в объемах. Это видно на снимках НМИЦ им. Н.Н.Петрова.
Скриншот: Youtube.com/Niioncologii
Но для других пациентов чудо обернулось проблемами или трагедией. Побочные эффекты от BCD-100 испытывали 80% пациентов, заявил на ноябрьской конференции доктор Федянин.
Чтобы разобраться, как работает BCD-100, важно понимать принцип работы иммунной системы человека.
Очень упрощённо иммунитет можно описать как систему «свой-чужой». Некоторые клетки крови умеют распознавать чужеродные бактерии и опасные тела и уничтожать их. Такой тип иммунных клеток называют Т-лимфоцитами. Получается эдакий «иммунный спецназ», который способен проникать через стенки сосудов в окружающие ткани и проводить там боевые действия против чужаков.
На поверхности Т-лимфоцита живёт белок PD-1, который отвечает за восприятие чужеродных клеток. Раковые же клетки «прячутся» от лимфоцитов, обманывая белок PD-1. Лимфоциты начинают думать, что раковая клетка — «своя», и не трогают смертельную опухоль.
Учёные по всему миру ломают головы над тем, как взломать маскировку и обучить лимфоциты распознавать в раковой клетке врага. Как уверяют создатели Miraculum, именно это им и удалось.
Создатели препарата рассчитывают, что его можно будет использовать не только для лечения меланомы и рака лёгких, но и других видов онкологии.
Поначалу на заводе «Биокад» рассчитывали выпустить лекарство на рынок в 2018 году. Сейчас сроки отодвинулись до 2022 года. Причин может быть множество: от недостаточного финансирования до неожиданно вскрывшихся проблем при использовании препарата.
В одном из интервью представители завода сравнивали цены на зарубежные аналогичные препараты. Выходило, что лечиться израильскими либо японскими средствами стоит примерно 9 миллионов рублей за курс. Отечественные разработчики обещали существенно меньшую цену за курс BCD-100. Возможно, в разы.
Лайф попросил эксперта, который много лет занимается клиническими исследованиями, рассказать о морально-этической стороне испытаний препаратов на людях. Вот что рассказала исполнительный директор Ассоциации организаций по клиническим исследованиям Светлана Завидова.
«Человечество двигалось к системе регулирования через лекарственные трагедии. Где-то, конечно, своим умом доходили, но в основном двигателем послужил негативный опыт, который и приводил к разработке тех или иных правил. Правила писали «на крови».
Светлана Завидова, Ассоциация по клиническим исследованиям
Один из первых мировых законодательных актов на тему регулирования исследований препаратов появился в США в 1938 году.
Взяться за его разработку пришлось после того, как из-за неподтверждённого по критериям безопасности препарата сульфаниламида погибло 107 человек, большинство из которых — дети.
Именно после этой трагедии фармпроизводителей обязали подтверждать безопасность лекарств. В том числе и на пациентах.
Исследования на людях идут в три фазы и длятся годами. В первую, как правило, включают только здоровых добровольцев. Вторая фаза — это испытания на пациентах, страдающих от конкретного заболевания. Обычно в них участвует несколько сотен человек.
Третья фаза — самая масштабная: здесь в выборку могут включить несколько тысяч больных. Именно на третьей фазе появляется большинство данных о побочных реакциях и их частоте. Все добровольцы подписывают информированное согласие, соглашаясь на все риски (вплоть до летального исхода).
Для многих пациентов участие в испытаниях — последний шанс.
Только при успешном завершении третьей стадии препарат регистрируют в госорганах и завозят в аптеки.
Второй случай изучают в медвузах как пример халатного отношения к безопасности препарата в угоду его продаваемости. Препарат талидомид в середине ХХ века был одним из самых продаваемых успокоительных и снотворных.
Особенно его рекомендовали беременным и кормящим матерям, чтобы справляться с ночной бессонницей, утренней тошнотой и беспокойством. При этом никакие тесты влияния таблеток на плод не проводились. Препарат активно продавался в Европе.
Через несколько лет стали чаще рождаться дети с патологиями: у новорожденных не было рук, ног либо ушей.
Ещё год потребовался властям нескольких стран, чтобы увязать страшную статистику с популярностью талидомида. Всё это время компания-производитель не признавала связи между этими событиями и продолжала рекламировать лекарство как безопасное.
Действия петербургской фармацевтической компании, которая не сообщила в Росздравнадзор о смерти пациента, на первый взгляд выглядят попыткой скрыть негатив во избежание репутационных и иных потерь. Однако в «Биокаде» заявляют, что специально ничего не утаивали.
«Первично полученные данные не соответствовали определению «Серьёзная непредвиденная нежелательная реакция». После получения дополнительных сведений информация была передана в Росздравнадзор».
Юридический департамент ЗАО «Биокад»
— Предположение о том, что ЗАО «Биокад» пыталось скрыть летальный случай, не соответствует действительности, поскольку данная информация сообщалась в ряд компетентных органов и учреждений, — добавили представители фармзавода. — Компания провела внутреннюю проверку, по результатам которой были детализированы внутренние процедуры.
Один из корпусов завода «Биокад» в Петербурге.
Компания «Биокад» создана в 2001 году. Это одна из крупнейших биотехнологических компаний России, где разрабатывают, изучают и производят новые типы лекарств. В штате трудятся более 1800 человек. Компания фокусируется на препаратах для терапии онкологических и аутоиммунных заболеваний, также ведёт разработки в области терапии других социально значимых заболеваний.
19 апреля 2019 года Национальный медицинский исследовательский центр радиологии Минздрава сообщил об увеличении числа онкобольных в стране. На первом месте в России рак лёгких. Каждый год онкологией заболевают около 600 тысяч человек. Всего в России на онкологическом учёте стоят 3,6 миллиона человек.
Вакцина от меланомы: чего удалось добиться ученым в 2019 году? « Клиники «Евроонко» | Клиники «Евроонко»
Активнее всего развиваются сферы медицины, которые имеют дело с распространенными трудноизлечимыми и неизлечимыми заболеваниями. Так, ученые всего мира неустанно ищут новые способы борьбы со злокачественными опухолями. И эта работа приносит плоды.
Например, прорывом в лечении меланомы на поздних стадиях стало создание иммунопрепаратов из группы ингибиторов контрольных точек: пембролизумаба (Китруда), ипилимумаба (Ервой), ниволумаба (Опдиво). Однако, несмотря на все свои преимущества, эти препараты помогают лишь примерно половине больных.
В остальных случаях опухоли не реагируют на лечение. А значит, нужно искать новые возможности.
Одно из перспективных направлений – применение противоопухолевых вакцин. Еще в 2015 году мы публиковали статью о том, как прошло первое клиническое испытание «прививки» против меланомы в Америке. А в сентябре 2018 года мы рассказывали, как противоопухолевая вакцина в сочетании с diprovocim помогла в лечении агрессивной меланомы у мышей и профилактике рецидивов.
С тех пор исследователи из разных стран не сидели сложа руки и продолжали работать в этом направлении. Расскажем, чего удалось добиться в 2019 году.
Опыт коллег из Германии
В апреле ученые из Майнцского университета имени Иоганна Гутенберга и немецкой биотехнологической компании BioNTech рассказали о своем успешном опыте применения «противомеланомных» вакцин на сайте Альянса по исследованию меланомы (Melanoma Research Alliance).
Данным направлением занимается доктор Угур Сахин (Ugur Sahin). Он создает вакцину для каждого пациента индивидуально. У больного берут образец опухоли и получают неоантигены – белковые молекулы раковых клеток, на которые с наибольшей вероятностью разовьется иммунный ответ. Каждая вакцина включает 20 таких «мишеней», и на ее создание уходит около шести недель.
На данный момент немецкими учеными создано два препарата:
- Вакцину IVAC-MUTANOME вводят в лимфатические узлы. Здесь антигены с наибольшей вероятностью встречаются с особыми дендритными клетками, которые «знакомят» с “врагами” T-лимфоциты, тем самым активируя противоопухолевый иммунный ответ. В настоящее время курс лечения – введение восьми доз IVAC-MUTANOME через определенные промежутки времени – получили 13 пациентов. Удалось добиться выраженной иммунной реакции против 60% содержащихся в препарате неоантигенов и снизить кумулятивную частоту метастатических рецидивов, что привело к устойчивой выживаемости без прогрессирования заболевания. На момент публикации статьи IVAC-MUTANOME проходила фазу II клинических испытаний в сочетании с иммунопрепаратом пембролизумабом (Китруда) при прогрессирующей меланоме.
- Вакцина Lipo-MERIT представляет собой неоантигены, «упакованные» в липидные частицы. Эту прививку не готовят индивидуально для каждого пациента, она содержит четыре антигена, экспрессия которых высока в большинстве меланом. На момент публикации статьи планировалось клиническое исследование, в котором будут участвовать 115 пациентов с меланомой III и IV стадии, включая тех, у кого были неэффективны ингибиторы контрольных точек. Предварительные результаты довольно обнадеживающие: из 22 пациентов, которым не помогали иммунопрепараты, после введения вакцины у 4 отмечался частичный ответ, у 8 – стабилизация, у 10 – прогрессирование.
Вакцина на основе дендритных клеток
В июле об успешных результатах фазы IIb клинических испытаний вакцины на основе дендритных клеток, нагруженных антигенами опухолевого лизата (TLPLDC), при меланоме III и IV стадии, сообщила биофармацевтическая компания Elios Therapeutics.
В ходе проспективного рандомизированного двойного слепого плацебо-контролируемого исследования эффективность нового препарата сравнили с плацебо у 144 пациентов. В течение 24 месяцев частота рецидивирования опухоли среди вакцинированных составила 29%, а среди невакцинированных – 56%. Нежелательные эффекты на фоне применения вакцины были отмечены у трети участников.
Снижение рисков почти на 50% – это хороший результат. Вдохновившись им, исследователи решили проверить выживаемость в течение 36 месяцев. Ожидается, что итоги будут подведены в июне 2020 года.
Нано-прививка
Исследователи из Тель-Авивского университета пошли дальше своих западных коллег и решили бороться с меланомой с помощью прививки на основе наночастиц. Они сообщили о результатах своей работы в августе.
Исследователи использовали крошечные частицы размером около 170 нанометров, изготовленные из биоразлагаемого полимера. В каждом из этих мини-снарядов спрятаны белки-антигены, которые экспрессируются в клетках меланомы. Новую вакцину проверили на лабораторных мышах разными способами:
- В целях профилактики. Животным вводили препарат, после чего в их организм «подсаживали» клетки меланомы. Ни одна мышь не заболела, а значит, вакцина помогает предотвратить меланому.
- В терапевтических целях. В данном случае вакцину применяли в сочетании с иммунопрепаратами. Это помогло существенно затормозить прогрессирование заболевания и продлить жизнь животных.
- Для лечения метастазов в мозге. Нановакцина была проверена на тканях человека, а также у мышей с метастазами в центральной нервной системе, у которых была удалена первичная опухоль.
Хотя все вакцины против меланомы на данный момент являются экспериментальными, в целом они показывают хорошую эффективность и безопасность.
А значит, есть все предпосылки для того, чтобы в будущем такие препараты стали доступны в онкологических клиниках по всему миру. Специалисты Европейской клиники продолжают следить за инновациями.
На данный момент пациенты с некурабельной и метастатической меланомой могут получить у нас лечение всеми видами зарегистрированных иммунопрепаратов из группы ингибиторов контрольных точек.
Ловушка для меланомы: в России создают вакцину от агрессивной опухоли
В России начаты работы по созданию индивидуализированной вакцины от наиболее агрессивного рака кожи – меланомы. Синтезированное вещество заблокирует возникновение рецидива опухоли. В конце 2020 года ученые планируют начать клинические испытания на людях. Главным исполнителем работы по госконтракту является Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина.
Меланома представляет собой наиболее агрессивную форму рака кожи. По данным ВОЗ, ежегодно в мире выявляется 132 тыс. новых случаев болезни. Для лечения меланомы применяется хирургическое вмешательство, лучевая и химиотерапия, но обычно после первичного удаления опухоли в большинстве случаев наступает рецидив.
Предыдущие исследования разных случаев меланомы показали, что опухоли на поздних этапах развития имеют механизмы избегания узнавания иммунной системой человека. Из-за этого иммунная система не может определить раковые клетки как чужеродные и уничтожить их.
Новый подход заключается в том, чтобы выявить уникальные мутации, которые появились в раковых клетках конкретного пациента.
Зная эти мутации, можно синтезировать неоантигены — короткие белки, которые идентичны участкам белков из опухолевой клетки, но отличаются от белков здоровых клеток.
Синтезированные неоантигены в виде вакцины вводятся пациенту после удаления первичной опухоли, и клетки иммунитета (Т-клетки) тренируются реагировать на них. Поэтому при появлении метастаз Т-клетки связываются с белками из раковых клеток, чтобы распознать и уничтожить их. Этот способ вместе с иммуностимулирующей терапией должен исключить возникновение рецидива.
— Именно эта стратегия была взята в основу создания нашей вакцины, — рассказал сооснователь компании «Ксивелью» Юрий Пеков. — Мы как подрядчик лаборатории трансгенных препаратов Национального медицинского исследовательского центра онкологии им. Н.Н. Блохина выполняем биоинформатическую часть.
Сейчас создаем программу, которая предсказывает, какие именно неоантигены нужно вводить мышам, чтобы на них отвечали клетки иммунитета. Из примерно тысячи потенциальных неоантигенов с помощью методов биоинформатики и машинного обучения нужно выбрать двадцать, из которых хотя бы часть будет надежно связываться с Т-лимфоцитами.
К октябрю будет сделан этот алгоритм и будут получены первые неоантигены, которые уже можно будет включить в вакцину для мышей.
Чтобы убедиться в состоятельности рабочей гипотезы, ученые вначале испытают вакцину на животных. Для этого заготовлены мыши чистой линии C57Bl/6. Все они имеют практически одинаковый геном, так как скрещиваются только с мышами той же линии.
Сначала мышам привьют клетки меланомы, чтобы искусственно смоделировать развитие настоящей опухоли. Потом будет прочитан геном (а точнее, экзом — не весь геном, а самые значимые его части) здоровой и опухолевой ткани каждой мыши. Эти последовательности нуклеотидов сравнят и найдут отличия, которые помогут выбрать наиболее вероятных кандидатов на роль неоантигенов для вакцины.
Испытание вакцины будет проходить уже на других мышах. Вакцину проверят на трех группах по 20–30 животных: контрольной (вкалывают только меланому), группе «лечение» (мыши вначале вкалывают опухоль, а потом вакцину и смотрят, сколько выжило по сравнению с контрольной группой) и группе «профилактика» (мышам вначале вкалывают вакцину, а потом — меланому).
— Здесь есть один нюанс, который состоит в том, что мы читаем геном одних мышей, а лечим других, — рассказала генеральный директор «Ксивелью» Дарья Яковишина.
— Но так как используемые мыши и клетки меланомы являются генетически однородными, эксперименту это не помешает.
В будущем, конечно, мы будем читать геном удаленной меланомы и здоровых тканей именно того пациента, которого собираемся лечить впоследствии.
По словам завгруппой генной иммуноонкотерапии Института биоорганической химии РАН Ирины Алексеенко, несколько неоантигенных вакцин против меланомы уже были испытаны и на животных, и на людях, но далеко не все из них продемонстрировали эффективность.
— Результаты первого испытания неоантигенной вакцины на людях были опубликованы в 2015 году, исследование проводилось в США всего на трех пациентах с меланомой. Было показано, что такие вакцины могут влиять на течение болезни.
В 2017 году уже исследователи из Германии отчитались о результатах применения неоантигенной вакцины у больных с меланомой: у девяти из 13 больных после лечения полностью исчезли опухолевые очаги и через год наблюдения не было обнаружено рецидива заболевания, — рассказала Ирина Алексеенко.
Однако, отмечает она, в ряде клинических испытаний применение неоантигенных вакцин не приводило к улучшению у онкологических больных. Это связано с тем, что эффективность таких вакцин зависит от того, насколько правильные неоантигены были выбраны и синтезированы учеными.
— Успешность вакцины, разрабатываемой нашими учеными, также будет зависеть от того, насколько им удастся подобрать и синтезировать правильный набор неоантигенов, способный активировать иммунный ответ против опухоли, — подчеркнула Ирина Алексеенко.
Разработка вакцины началась в апреле этого года. Ученые надеются дойти до клинических испытаний на людях в конце 2020 года. На начальном этапе расчетная стоимость вакцины для конкретного пациента составит 1,5 млн рублей, впоследствии возможно ее удешевление.
В россии создали эффективную вакцину от меланомы кожи и рака почки
Исследователи из НМИЦ онкологии им. Н. Н. Петрова создали новую вакцину против рака, которая может быть создана из собственных опухолевых клеток пациента.
Ее применение увеличило пятилетнюю выживаемость до 25,1% пациентов и десятилетнюю выживаемость до 22% пациентов с III–IV стадиями меланомы кожи и рака почки.
Исследователи также обнаружили, что на эффективность лечения злокачественных новообразований влияет уровень продукции опухолевыми клетками белка MICA, который блокирует рецепторы Т-лимфоцитов. Свою статью исследователи опубликовали в журнале The Oncologist.
Новую вакцину на основе аутологичных опухолевых клеток (собственных опухолевых клеток пациента), модифицированных геном tag7/PGRP-S, российские исследователи начали разрабатывать еще в 2001–2009 годах. Тогда еще не существовало эффективных препаратов для иммунотерапии.
Онкологи не верили, что можно «разбудить» противоопухолевый иммунитет, помочь ему обнаружить и уничтожить раковые клетки.
Пациенты с меланомой и раком почки тогда получали только хирургическое лечение без лекарственной терапии, так как при таких дозах она оказывалась малоэффективной.
Группа исследователей из Института биологии гена РАН под руководством академика Георгия Георгиева во время экспериментов на мышах обнаружила ген tag7. Его внедрение в опухолевые клетки замедляло их рост. Предполагалось, что белок tag7 участвует в передаче сигнала антигенпрезентирующим дендритным клеткам, которые «показывают» T-лимфоцитам мишень для уничтожения.
Затем ученые обнаружили аналог гена tag7 в клетках иммунной системы человека. Они предположили, что его можно использовать в противоопухолевой терапии. Чтобы изготовить вакцину, ученые на первом этапе отобрали образцы опухоли пациентов.
Затем авторы переносили образцы в культуру, трансфицировали геном tag7, после чего с помощью ионизирующего излучения уничтожали способность опухолевых клеток размножаться. Трансфицированные опухолевые клетки могут жить в организме пациента до двух месяцев, не вызывая при этом онкологических заболеваний.
При этом клеточные структуры могут синтезировать белок Tag7, который привлекает и активирует иммунную систему.
Полученный продукт вводили пациентам подкожно каждые три недели до прогрессирования заболевания или в течение двух лет с момента начала лечения. С 2001 по 2014 год в исследовании, которое проводилось на базе научного отдела онкоиммунологии НМИЦ онкологии им. Н. Н. Петрова, приняли участие 80 пациентов. Из них 68 с меланомой кожи и 12 с раком почки.
У 26 (33%) пациентов медики установили III стадию заболевания, у 54 (67%) — IV стадию. В качестве адъювантной терапии вакцину получали 19 больных: 17 с меланомой, 2 с раком почки. В лечебном режиме, то есть после неполного удаления опухоли и уже после обнаружения метастазов, — 61 пациент: 51 с меланомой кожи, 10 с раком почки.
Никто из них не получал другого лечения.
С 2014 по 2018 год ученые наблюдали за пациентами. Оказалось, что пятилетняя общая выживаемость в совместной группе больных и меланомой, и раком почки составила 25,1%. Различий в общей выживаемости между ними не было.
При этом десятилетняя общая выживаемость составила 22% для пациентов с меланомой кожи, 42% — для пациентов с меланомой кожи с благоприятным прогнозом.
Для сравнения, обычно пятилетняя общая выживаемость больных с меланомой кожи, получавших ипилимумаб (иммуноонкологический препарат), составила 17%.
В ходе исследования ученые также пытались выяснить, благодаря чему лечение генномодифицированной вакциной было эффективно для одних пациентов и не эффективно для других. Для этого они оценивали свойства опухоли, индивидуальные у каждого пациента. Выяснилось, что прогноз выживаемости коррелирует с уровнем белка MICA.
Если этот белок избыточно продуцируется опухолевыми клетками, то его молекулы попадают в опухолевое микроокружение, а затем в кровоток, где соединяются с рецепторами на Т-лимфоцитах и NK-клетках (клетках-киллерах) и блокируют их способность уничтожать раковые.
Таким образом, от присутствия белка MICA зависела эффективность лечения пациента.
Российские ученые разрабатывают вакцину от меланомы | Телеканал 360°
В Национальном медицинском исследовательском центре онкологии имени Н. Н. Блохина по госконтракту разрабатывают индивидуализированную вакцину от самого агрессивного вида рака кожи — меланомы. На конец 2020 года намечены клинические испытания на людях. Об этом сообщили «Известия».
По данным ВОЗ, в мире ежегодно выявляют 132 тысячи новых случаев заболеваний агрессивной формой рака кожи — меланомой. Сложность лечения в том, что после удаления опухали наступает рецидив, а иммунная система не уничтожает раковые клетки, так как не распознает их как чужеродные.
Российские ученые разработали метод выявления уникальных мутаций, которые появились в раковых клетках отдельного пациента.
«Зная эти мутации, можно синтезировать неоантигены — короткие белки, которые идентичны участкам белков из опухолевой клетки, но отличаются от белков здоровых клеток», — сообщили ученые.
Вакцина и иммуностимулирующая терапия могут исключить рецидив. Лекарство разрабатывают с апреля текущего года.
Ученые РФ получили первые положительные результаты испытаний ДНК-вакцины от меланомы
НОВОСИБИРСК, 26 сентября. /ТАСС/. Ученые Национального медицинского исследовательского центра им. академика Е. Н.
Мешалкина (клиники Мешалкина) совместно с исследовательской группой государственного научного центра вирусологии и биотехнологии «Вектор» Роспотребнадзора разработали ДНК-вакцину от рака кожи (меланомы) и получили первые положительные результаты на клетках — вакцина заставила заработать иммунитет, который впоследствии должен бороться с опухолью. В следующем году начнется подготовка к клиническим испытаниям вакцины, сообщил ТАСС руководитель центра онкологии и радиотерапии клиники Мешалкина Александр Жеравин.
«Мы разрабатываем ДНК-вакцину от меланомы. Существуют разные схемы лечения онкологии — лекарственная, химическая, таргетная терапия, но мы хотим запустить собственные силы организма на борьбу с опухолью, иммунную систему.
Исследовательской группой проведена тщательная работа по подготовке векторных систем, которые способны доставлять генетический материал в иммунно-компетентную клетку [способную давать иммунный ответ] и заставлять ее работать.
Эксперименты и лабораторные тесты позволяют говорить, что наша схема — работоспособная, и следующий год мы можем посвятить подготовке к клиническим испытаниям», — рассказал Жеравин.
Вакцина рассчитана на тех людей, у которых уже диагностирована меланома. По словам ученого, суть иммунной терапии рака заключается в том, чтобы обойти методы защиты опухолевой клетки.
«Основная проблема онкологических заболеваний заключается в том, что опухолевые клетки умеют ускользать от иммунного ответа.
ДНК-вакцины по сути активируют иммунно-компетентные клетки, которые находятся в организме больного человека», — отметил он.
Как рассказала ТАСС сотрудница центра онкологии и радиотерапии клиники Мешалкина Елена Боробова, ДНК-вакцина от меланомы представляет молекулу, в структуру которой включен специальный ген.
«После того, как эта ДНК попадает в иммунные клетки, идет считывание информации с целевого гена. В результате идет наработка белка, который закодирован в этом гене.
Этот белок запускает каскад иммунных реакций, которые приводят к активации иммунных клеток против клеток меланомы», — пояснила она.
Дизайн вакцины был сделан с помощью программного обеспечения «Вектора», отметила Боробова: с помощью математических моделей был рассчитан необходимый целевой ген. Испытания на лабораторных животных показали, что вакцина не токсична.
Доказана высокая эффективность геномодифицированной противоопухолевой вакцины при меланоме кожи и раке почки
Дата публикации: 28.05.2020
Применение вакцины, изготовленной из собственных опухолевых клеток пациента, модифицированных геном tag7, обеспечило общую 5-летнюю выживаемость 25,1% пациентов и общую 10-летнюю выживаемость 22% пациентов с III-IV стадиями меланомы кожи и рака почки. Ученым также удалось обнаружить, что на эффективность лечения злокачественных новообразований влияет уровень продукции опухолевыми клетками белка MICA, который блокирует рецепторы Т-лимфоцитов и мешает им уничтожать раковые клетки.
К этим результатам пришли специалисты НМ�Ц онкологии им. Н.Н.
Петрова при оценке эффективности лечения геномодифицированной вакциной, которое пациенты получили в 2001-2014 годах в рамках исследования, инициированного Центром и �нститутом биологии гена РАН. Об этом сообщается в статье, опубликованной в журнале Oncologist.
Вакцина на основе аутологичных опухолевых клеток (собственных опухолевых клеток пациента), модифицированных геном tag7/PGRP-S – совместная разработка НМ�Ц онкологии им.
Н.Н. Петрова и �нститута биологии гена Российской академии наук. Работа над проектом велась в рамках гранта Правительства Москвы в 2001-2009 годах.
В то время современных иммуноонкологических препаратов, которые сегодня перевернули представление о лечении онкологических заболеваний, еще не существовало.
Онкологи не верили, что можно «разбудить» противоопухолевый иммунитет, помочь ему обнаружить и уничтожить раковые клетки, которые, чтобы стать для него невидимыми, вырабатывают различные факторы-блокаторы.
Пациентам с меланомой и раком почки могли предложить только хирургическое лечение, системного лекарственного лечения в адъювантном режиме (послеоперационном, поддерживающем режиме) они не получали, так как стандартная химиотерапия при таких диагнозах малоэффективна.
Научная гипотеза
Группа исследователей из �нститута биологии гена РАН под руководством академика Георгия Павловича Георгиева во время экспериментальных исследований на мышах обнаружила ген tag7.
Его трансфекция в опухолевые клетки замедляла их рост. �ными словами, перенос в опухоль генетической информации, которую несет ген tag7, активировала клетки иммунной системы.
Предполагалось, что белок Tag7 принимает участие в передаче сигнала антигенпрезентирующим дендритным клеткам – виду клеток, которые демонстрируют T-лимфоцитам – клеткам-киллерам, мишень для уничтожения.
�сследователям удалось обнаружить аналог гена tag7 в клетках иммунной системы человека.
Они предположили, что ген может использоваться в противоопухолевой терапии.
�сследования �нститута биологии гена РАН и стали научной базой для создания вакцины на основе аутологичных опухолевых клеток, модифицированных геном tag7/PGRP-S.
Как изготавливается вакцина
Вакцина изготавливается из клеток опухоли самого пациента, которые берутся из операционного материала.
Образцы опухоли пациентов переносили в культуру, трансфецировали геном tag7, после чего способность опухолевых клеток размножаться уничтожалась с помощью радиации.
Трансфецированные опухолевые клетки могут жить в организме пациента около двух месяцев, не давая смертельно опасного потомства, и синтезировать белок Tag7, который привлекает и активирует клетки иммунной системы.
Полученный продукт вводили пациентам подкожно каждые три недели до прогрессирования заболевания или в течение двух лет с момента начала лечения.
Как проходило исследование
С 2001 по 2014 год в исследовании, которое проводилось на базе научного отдела онкоиммунологии НМ�Ц онкологии им. Н.Н. Петрова, приняли участие 80 пациентов.
�з них 68 с меланомой кожи и 12 с раком почки. У 26 (33%) пациентов установлена III стадия заболевания, у 54 (67%) – IV стадия.
В качестве адъювантной терапии вакцину получали 19 больных: 17 с меланомой, 2 с раком почки.
В лечебном режиме, то есть после неполного удаления опухоли и уже после обнаружения метастазов – 61 пациент: 51 с меланомой кожи, 10 с раком почки. Никто из них не лечился другими иммунотерапевтическими препаратами и методами.
Как оценивалась эффективность
С 2014 года проводилось наблюдение за пациентами, которое было завершено к 2018 году.
В описанной публикации проведен заключительный анализ отдаленных результатов исследования, которые в первую очередь определяются по общей выживаемости.
Общая выживаемость – это процент пациентов с определенным типом и стадией рака, которые не умерли от любых причин в течение определенного периода времени после постановки диагноза.
Выяснилось, что 5-летняя общая выживаемость в совместной группе больных и меланомой, и раком почки составила 25,1%.
Различий в общей выживаемости между ними не было.
10-летняя общая выживаемость составила 22% для пациентов с меланомой кожи, 42% – для пациентов с меланомой кожи с благоприятным прогнозом.
Для сравнения, по литературным данным, 10-летняя общая выживаемость больных с меланомой кожи, получавших ипилимумаб (иммуноонкологический препарат, зарегистрированный в России в 2016 году), составила 17%.
Медиана общей выживаемости (время, которое переживают 50% больных) – 6,6 лет в группе благоприятного прогноза и 4,6 мес.– в группе неблагоприятного прогноза.
Для больных меланомой кожи III-IV стадии медиана общей выживаемости в группе благоприятного прогноза составила 2,3 года, при этом 31% пациентов прожили более 10 лет.
В группе неблагоприятного прогноза медиана общей выживаемости составила всего 0,4 года (около 5 мес.).
В ходе исследования ученые также пытались понять, за счет чего лечение геномодифицированной вакциной было эффективно для одних пациентов и не эффективно для других. Они оценивали свойства опухоли, подавляющие иммунную систему, индивидуальные у каждого пациента.
После сбора данных об общей выживаемости пациентов, получивших лечение геномодифицированной вакциной, и изучения культуры их опухолевых клеток, которая хранилась в банке биологических образцов НМ�Ц онкологии им. Н.Н. Петрова, была проведена математическая обработка данных.
Пациентов разделили на две группы: благоприятного прогноза, с достаточным эффектом (остановка прогрессирования, уменьшение или исчезновение опухоли, ремиссия) и неблагоприятного прогноза, с недостаточным эффектом (быстрое прогрессирование или смерть). Затем сравнили их опухолевые клетки. Оказалось, что клетки пациентов с недостаточным эффектом активно продуцировали иммуносупрессирующие факторы. На основании данных о свойствах опухолей ученые построили четыре прогностические модели, базирующиеся на четырех данных об иммуносупрессирующих факторах. Одна из прогностических моделей оказалась наиболее эффективной.
Выяснилось, что прогноз определяется по уровню MICA.
Если этот белок избыточно продуцируется опухолевыми клетками, то его молекулы попадают в опухолевое микроокружение, а затем в кровоток, где соединяются с рецепторами на Т-лимфоцитах и NK-клетках (клетках-киллерах) и блокируют их способность уничтожать раковые клетки. Таким образом, от присутствия белка MICA зависела эффективность лечения пациента.
Тем не менее очевидно, что геномодифицированная аутологичная вакцина – это дополнительная возможность продлить жизнь тысячам пациентов с меланомой кожи и раком почки, потому что ни один из применяемых на сегодняшний день лекарственных препаратов не является панацеей, не обладает 100% эффективностью. Вакцина может дать шанс на ремиссию пациентам с исчерпанными возможностями стандартного лечения.
Почему работа над проектом в настоящее время приостановлена
Несмотря на впечатляющие результаты, работа над геномодифицированной вакциной приостановлена. В связи с тем, что в начале 2017 года вступил в силу Федеральный закон от 23.06.
2016 № 180-ФЗ «О биомедицинских клеточных продуктах», вакцина на основе аутологичных опухолевых клеток, модифицированных геном tag7/PGRP-S, должна снова пройти весь цикл доклинических и клинических исследований.
Рто требует существенных финансовых затрат, Р° также времени, ведь ученым РІРЅРѕРІСЊ придется начать СЃ исследований РЅР° лабораторных животных, Р° значит РґРѕ использования вакцины РІ клинической практике даже РІ рамках экспериментального исследования пройдет РЅРµ менее 10-15 лет.