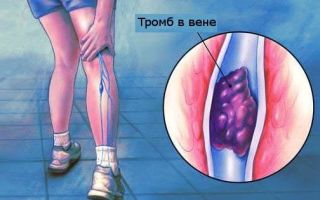
Почему развивается тромбоз в организме людей с коронавирусом?
Последние данные из Европы показывают, что у 30-70% пациентов с коронавирусом, поступающих в отделения интенсивной терапии (ОИТ) выявляются тромбы в глубоких венах ног или в лёгких.
Вирус вызывает повреждение стенки сосудов, что запускает процесс тромбообразования, который в норме защищает человека от кровотечения.
При ковиде поражение эндотелия приводит к активации системы комплимента, повышение активности иммунной системы, которая атакует собственные клетки организма.
Примерно у каждого четвёртого пациента с коронавирусом, поступившего в отделение интенсивной терапии, развиваются признаки тромбоэмболии лёгочной артерии. Постельный режим сам по себе повышает риск тромбоза нижних конечностей при коронавирусе. Частота тромбоза намного выше, чем мы обычно наблюдаем у пациентов, нуждающихся в госпитализации по другим причинам, отличным от COVID-19.
Повышенный риск инсульта
Пациенты, поступающие в больницу с COVID-19, также более подвержены инсульту по сравнению с неинфицированным населением.
Вероятность инсульта обычно связана с возрастом, а также с другими факторами риска, такими как высокое кровяное давление, повышенный уровень холестерина или курение.
Однако выявлена более высокая частота инсультов у пациентов с COVID-19 у людей в возрасте до 50 лет, без других факторов риска инсульта. У пожилых людей, принимающих лекарства против тромбов снижаются риски сосудистых катастроф при Covid-19.
Низкий уровень кислорода
COVID-19 также связан со сгустками крови в крошечных кровеносных сосудах, которые важны для переноса кислорода в органах. В отчётах о вскрытии обнаружены элементы SARS-CoV-2, вируса, вызывающего COVID-19, в клетках, выстилающих эти небольшие кровеносные сосуды в лёгких, почках и кишечнике.
Это может привести к образованию крошечных сгустков крови в этих мелких кровеносных сосудах, которые нарушают нормальный кровоток и способность крови доставлять кислород к этим органам. Важно отметить, что эти небольшие сгустки крови могут нарушить нормальную функцию лёгких. Это может объяснить, почему у пациентов с тяжёлой формой COVID-19 может быть очень низкий уровень кислорода.
Как лечить и диагностировать тромбы
Когда пациенты поступают в больницу из-за ковида, обычной практикой является введение низких доз антитромботических препаратов для предотвращения образования тромбов. С 2020 года проводятся испытания, чтобы уточнить схемы назначения этих препаратов для максимального эффекта. Диагностика этих тромбов у пациентов с COVID-19 также может быть особенно сложной задачей.
Симптомы обострения лёгочной инфекции, связанной с вирусом, могут быть неотличимы от симптомов тромбоэмболии лёгочной артерии. Симптомы тромбоза глубоких вен после коронавируса неотличимы от классических:
- Отёк голени и стопы.
- Болезненность мышц голени.
- Вздутие подкожных вен.
Основные лабораторные признаки тромбоза при коронавирусе включают изменения коагулограммы. Проблема, связанная с COVID-19, заключается в том, что вирус может влиять на лабораторные тесты, которые также могут использоваться для диагностики венозных сгустков крови. У некоторых пациентов это означает, что тест на D-димер возможно не помогает диагностировать тромбы и вовремя начать их лечить.
Каждому пациенту с диагностированной коронавирусной инфекцией необходимо проводить исследование вен нижних конечностей. Обычно для этой цели достаточно ультразвуковой диагностики.
Важно понимать, что тромбы могут возникать и в отдалённом периоде после заболевания, поэтому стандартом должна быть ультразвуковая диагностика вен ежемесячно на протяжении полугода после перенесённого ковида.
Точный диагноз тромбоза, как осложнения коронавируса может поставить флеболог с помощью УЗИ диагностики. Назначение лекарственных средств против тромбозов позволит предотвратить тяжёлые осложнения.
Почему COVID-19 вызывает свёртывание крови?
Одна из теорий заключается в том, что повышенная скорость образования тромбов при ковиде — это просто отражение общего недомогания и неподвижности. Однако текущие данные показывают, что риск образования тромбов и тромбоэмболии у пациентов с ковидом значительно выше, чем у пациентов, госпитализированных в стационар и в отделения интенсивной терапии.
Другое возможное объяснение заключается в том, что вирус напрямую влияет на клетки, выстилающие наши кровеносные сосуды. Когда организм борется с инфекцией, иммунная система активируется, чтобы попытаться убить захватчика, и исследования показывают, что при атаке активированной иммунной системы в стенках сосудов образуются тромбы, которые довольно редко отрываются.
Предварительные исследования показывают, что обычно используемый гепарин для профилактики тромбоза при коронавирусе, может оказывать противовирусное действие, связываясь с SARS-CoV-2 и подавляя ключевой белок, который нужно использовать вирусу для закрепления на клетках.
Что мы знаем точно, так это то, что осложнения со свёртыванием крови быстро становятся серьёзной угрозой COVID-19. В этой области нам ещё многое предстоит узнать о вирусе, о том, как он влияет на свёртываемость крови, и проверить данные о лучших вариантах профилактики и лечения этих тромбов.
Фиолетовые высыпания, опухшие ноги, закупоренные катетеры и внезапная смерть — это тромбы сосудов при коронавирусе, большие и маленькие, являются частым осложнением.
Двойной удар
Сгустки крови, желеобразные сгустки клеток и белков, являются механизмом организма для остановки кровотечения. Тромбы образуются в сосудах в ответ на повреждение внутренней стенки. Некоторые исследователи рассматривают свёртывание крови как ключевую особенность COVID-19.
Воздействие вируса на иммунную систему также может проявляться повышенной свёртываемостью крови.
У некоторых людей COVID-19 побуждает иммунные клетки высвобождать поток химических сигналов, усиливающих воспаление, которое связано с коагуляцией и свёртыванием крови различными путями.
И вирус, похоже, активирует систему комплемента, защитный механизм, который вызывает свёртывание крови и повышает риск тромбоза при коронавирусе.
Как избежать тромбоза лёгких при коронавирусе?
Препараты, разжижающие кровь, являются стандартом лечения пациентов в отделении интенсивной терапии, и пациенты с COVID-19 не являются исключением. Но дозировка — это вопрос горячих дебатов.
Истинная распространённость тромбоза, связанного с инфекцией COVID-19, неизвестна, поскольку большинство исследований на сегодняшний день не включают протоколы систематических и всеобъемлющих исследований.
Похоже, что также важно учитывать стадию течения болезни и место обследования пациента: обычная палата или отделение интенсивной терапии (ОИТ).
Оба этих фактора будут влиять на количество антикоагулянтов, которое может получить пациент, что, в свою очередь, может повлиять на последующий тромбоз.
Большинство исследований относится к тромбоэмболии лёгочной артерии (ТЭЛА), тогда как есть убедительные доказательства того, что большая часть этого может быть тромбозом лёгочной артерии « in situ». Высокая частота тромбоза лёгких при COVID-19, вероятно, обусловлена слиянием трёх процессов:
- интенсивного эндотелиального воспаления, описанного выше, приводящего к тромбозу « in situ », включая тромбоз микрососудов;
- уменьшение лёгочного кровотока в ответ на паренхиматозный процесс проявляется низкой скоростью движения крови в сосудах;
- классический переход тромбоза глубоких вен в тромбоэмболию лёгочной артерии.
Срочно необходимо проверить результаты текущих испытаний для дальнейшего информирования клинической практики об использовании антикоагулянтов. Сюда входят как пациенты, госпитализированные в отделения интенсивной терапии, так и пациенты из группы риска, находящиеся в палате общего профиля.
Для пациентов, не нуждающихся интенсивной терапии важно решить: каковы поводы для более интенсивной антикоагуляции там, где визуализация недоступна? Можно ли назначать антикоагулянты, используя только анализ на D-димер, и какие пороговые значения следует использовать для точки отсчёта?
Антикоагулянтные препараты
Выбор антикоагулянта, который будет вам назначен, основан на различных факторах: функции почек, массе тела и других принимаемых вами лекарствах.
Профилактика тромбозов при ковиде должна проводится с первого дня после установления диагноза и продолжаться не менее месяца после прекращения всех симптомов перенесённого заболевания.
Стоит иметь в виду, что некоторые антитромботические препараты получены из животных (свиного происхождения). Существуют таблетированные и инъекционные формы лекарственных препаратов, которые выбирает врач.
Назначаемые схемы
Таблетка ривароксабана, 10 мг один раз в день — принимать примерно в одно и то же время каждый день. Ривароксабан не лицензирован для предотвращения образования тромбов у людей с COVID-19, но используется по другим показаниям, чтобы избежать образования тромбов.
Инъекция эноксапарина, доза зависит от вашего веса и функции почек — принимать примерно в одно и то же время каждый день. В отличие от обычного гепарина при приёме этих лекарственных средств нет необходимости делать анализы крови на свёртываемость.
Как долго нужно пить антикоагулянты?
Вам будет предоставлена подробная информация о том, как долго вам следует принимать антикоагулянтные препараты, а также инструкции на этикетке лекарства и больничной документации. Обычно срок антитромботической профилактики не менее месяца после исчезновения всех клинических проявлений.
Перед окончанием профилактического курса необходимо провериться на УЗИ и определить необходимость его продолжения. Такой подход позволит предотвратить развитие поздних тромботических осложнений в виде постэмболической пневмонии и массивной ТЭЛА.
В информационном поле постоянно появляются случаи преждевременной смерти от тромбоэмболии через несколько месяцев после перенесённой коронавирусной пневмонии. Важно, чтобы вы пили лекарства в течение рекомендованного времени и завершили курс.
Что делать, если вы пропустите приём?
Если вы пропустили приём и вспомнили об этом в тот же день, примите пропущенную дозу, как только вспомните, в этот день. Примите следующую дозу на следующий день и продолжайте принимать один раз в день. Не принимайте двойную дозу, чтобы восполнить пропущенную дозу. При любых подозрениях на тромбоз необходимо провериться флеболога, чтобы определить возможные тромбы.
Инновационный сосудистый центр https://angioclinic.ru/
Неврологические осложнения коронавирусной инфекции
Неврологические осложнения коронавирусной инфекции на сегодняшний день описаны в многочисленных источниках [1]. Однако до сих пор в некоторых случаях установление причинно-следственной связи затруднительно
Неврологические осложнения разделены на три большие группы: осложнения со стороны центральной (инсульт, энцефалит, внутримозговые и субарахноидальные кровоизлияния, головная боль, головокружения, нарушения сознания, атаксия, судороги [2] и др.), со стороны периферической нервной системы (аносмия, дизгевзия, синдром Гийена-Барре, мононевропатии и др.) и скелетн-мышечно системы [3].
- Однако до сих пор в некоторых случаях установление причинно-следственной связи затруднительно.
- Например, инсульт может происходить по причинам, не связанным с коронавирусной инфекцией, а менингоэнцефалит и синдром Гийена–Барре являются параинфекционными [4].
- Воздействие вируса на нервную систему подразделяют на прямое нейротропное действие и непрямое действия вируса с развитием энцефалопатии, миопатии, нейропатии критических состояний [5].
- Безусловно, интересны отдаленные последствия COVID-19: депрессия, обсессивно-компульсивное расстройство, бессонница, снижение когнитивных функций, ускоренное старение, развитие нейродегенеративных заболеваний [6] и их прогрессирование [7].
К счастью, тяжелая патология ЦНС в виде инсульта, энцефалита, синдрома Гийена-Барре, миелита, и др., встречается не часто. Однако у всех пациентов, особенно перенесших коронавирус в тяжелой форме, имеет/имела место гипоксия головного мозга в той или иной степени выраженности.
НА фоне гипоксии, у подавляющего большинства пациентов отмечается дисфункция вегетативной нервной системы. Проявляется она, в первую очередь, нарушением ауторегуляции гомеостаза и функций организма, направленных на обеспечение жизнедеятельности.
Именно поэтому наблюдаются обострения хронической соматической патологии.
Мы видим декомпенсацию артериальной гипертензии, которая резистентна к гипотензивным препаратам и склонны списывать такие проявления на побочные действия терапии глюкокортикостероидами.
Это можно рассматривать, как проявление нарушения работы надсегментарных центров вегетативной нервной системы, которое приводит к сбою регулирования целесообразной слаженной работы систем и органов.
То-же самое происходит с некупируемой гипергликемией в остром периоде и на этапе восстановления.
Формируется замкнутый круг: вирусная инфекция вызывает гипоксию мозга, в результате развивается нарушение ауторегуляции внутренних функций и систем, что приводит к разбалансировке их деятельности и еще больше способствует развитию гипоксии мозга.
Можно предположить, что неадекватная гиперреакция иммунитета (цитокиновый шторм), аутоиммунные вторичные осложнения [9]– это также результат сбоя надсегементарной вегетативной ауторегуляции процессов жизнеобеспечения. Как результат нейротропного воздействия коронавирусной инфекции.
С самых первых дней коронавирусной инфекции и на этапе восстановления, целесообразна нейрометаболическая поддержка головного мозга, учитывая его ишемически-гипоксическое поражение [14].
Такая терапия показана всем пациентам, перенесшим коронавирус, но особенно тем, кто перенес болезнь в тяжелой форме.
Учитывая большой ажиотаж вокруг пандемии COVID-19, большое количество людей, охваченных тревожно-фобическими расстройствами, вплоть до нарушений социальной адаптации, проводить такую нейрометаболическую терапию нужно осторожно.
Стараясь не спровоцировать еще больший рост тревоги, нарушений сна, судорожных синдромов, повышения АД, гипергликемии и т.п. Направления нейропротективной, нейрометаболической терапии следует выстраивать по следующим направлениям: 1.
Антиоксидантная защита нервной системы от прогрессирования патологического процесса 2. Метаболическая поддержка центральной нервной системы, находящейся в 3. Купирование проявлений патологической тревоги, депрессивного и невротического расстройств 4.
Купирование астенического синдромокомплекса 5. Коррекция нарушений сна 6. Купирование психо-вегетативного синдрома, периферической вегетативной недостаточности.
Всем пациентам, перенесшим COVID-19 целесообразно назначение антигипоксантов [15] и антиоксидантов, которые подавляют перекисное окисление липидов и активируют антиоксидантную систему, повышают устойчивость клеток головного мозга к ишемии, гипоксии, активируют аэробный гликолиз, энергосинтезирующую функцию митохондрий, модулирует активность мембраносвязаных рецепторов, улучшают синаптическую передачу нейромедиаторов, модулирует активность мембаносвязаных рецепторов
Статья добавлена 29 июня 2021 г.
Осложнения после коронавируса
Перенесенная коронавирусная инфекция сказывается на работе всех органов и систем человека и не зависит от формы болезни — легкой, бессимптомной или тяжелой. Достаточно часто осложнения провоцируют и препараты, используемые во время лечения.
Последствия коронавируса для организма могут проявляться в виде нарушения иммунитета, вызывать склонность к аутоиммунным заболеваниям щитовидной железы, почек, сердца.
Восстановительный период после Covid-19 занимает от месяца до года и может сопровождаться определенными симптомами осложнения коронавируса, которые следует знать переболевшим.
Классификация осложнений после коронавируса
Осложнения и долгосрочные последствия ковида можно условно разделить следующим образом.
Легкая форма
- Незначительное снижение иммунитета;
- снижение работоспособности;
- одышка (при физической нагрузке);
- быстрая утомляемость и слабость;
- отсутствие аппетита;
- эмоциональная неустойчивость.
Средняя форма
Осложнения после коронавируса с пневмонией.
- Одышка в покое и длительный кашель;
- нарушения работы сердца, почек и печени;
- фиброзные изменения в легочной ткани;
- длительная астения и мышечная слабость;
- обострение хронических заболеваний.
Тяжелая форма
- Вирусный миокардит (воспаление сердечной мышцы);
- сердечная недостаточность;
- почечная недостаточность;
- легочный фиброз — необратимые изменения в легких;
- тромбозы вен;
- осложнения после ИВЛ.
Какие последствия после коронавируса самые распространенные:
- Дыхательные проблемы — кашель и одышка, легочный фиброз.
- Ослабление иммунитета.
- Нарушение работы сердечно-сосудистой системы — миокардит, опасные для жизни аритмии, сердечная недостаточность, инфаркт.
- Потеря обоняния (аносмия) и вкуса.
- Осложнения на уши — повреждение слуховых нервов, появление тугоухости.
- Ухудшение зрения.
- Воспаление нервных окончаний — главный симптом — нарушение чувствительности различных частей тела.
- Проявления астенического синдрома.
- Тромбоз — сгущение крови — результат коронавирусной инфекции.
- Кожные высыпания (по типу васкулита).
- Усиленное выпадение волос.
- Мужское бесплодие.
- Плохая регуляция эмоций, снижение памяти, способности к обучению.
- Расстройство мочевыводящей системы — у 30% переболевших ковидом.
- Поражения печени.
- Псевдомембранозный колит — нарушение флоры кишечника и воспаление слизистой оболочки, очень серьезное осложнение антибиотикотерапии.
Особенно часто осложнения после коронавируса наблюдаются у пациентов с сахарным диабетом, гипертонией, заболеваниями дыхательной и сердечно-сосудистой системы, заболеваниями почек и печени. В группу риска также входят люди старше 65 лет, онкологические больные, курильщики и люди с избыточным весом.
Поделитесь статьёй в соцсетях:
Дефицит электролитов на фоне новой коронавирусной инфекции и постковидного астенического синдрома
Астенический синдром является защитной реакцией организма на дистресс различного характера, ведущий к истощению энергетических ресурсов, и развивается у пациентов с острой соматической патологией или в период обострения хронического заболевания [1].
Проявляется астения неспецифическими жалобами на патологическую слабость, утомляемость (вне зависимости от вида нагрузки), бессонницу, раздражительность, неспособность расслабиться в сочетании с мышечной болью, головной болью напряжения, головокружением и вегетативной дисфункцией [2].
Распространенность астенического синдрома в общесоматической практике варьирует от 15% до 57%: у пациентов с хроническими соматическими заболеваниями встречается в 45% наблюдений, у больных, перенесших острое заболевание, в том числе инфекционное, — в 55% [3]. Постинфекционный астенический синдром (ПИАС) встречается у 75% пациентов после перенесенного заболевания бактериальной или вирусной природы.
Клинические проявления астении возникают через 1–2 нед. после купирования симптомов инфекционного заболевания и могут сохраняться в течение нескольких месяцев [3, 4]. Их выраженность зависит от тяжести интоксикационного синдрома, наличия осложнений, возраста и преморбидного фона.
Для легкой степени ПИАС характерны жалобы на слабость, усталость, разбитость, незначительные проблемы со сном. Средняя степень выраженности ПИАС проявляется болевым синдромом (миалгии, артралгии, краниалгии) и стойким нарушением сна.
При выраженной степени ПИАС пациент неспособен выполнять какую-либо физическую или умственную нагрузку, отмечает тремор, тахикардию, одышку, реже тошноту. Появляются трудности с засыпанием, тревожные сновидения [4].
В Международной классификации болезней 10-го пересмотра отдельно выделен синдром G93.3 — синдром усталости после перенесенной вирусной инфекции [5].
ПИАС — один из самых частых и стойких синдромов у пациентов, перенесших COVID-19 — инфекционное заболевание, вызванное SARS-CoV-2, его симптомы могут сохраняться в течение 100 дней и более после перенесенной инфекции.
Отдельно выделено «Состояние после COVID-19» (МКБ-10 U09.9) [5], которое характеризуется прогрессирующей органной патологией, полинейропатией, аутоиммунными нарушениями и длительным выраженным астеническим синдромом [6].
Патогенез ПИАС при COVID-19
Ключевую роль в патогенезе астении играет гипоталамо-гипофизарно-адреналовая система — главная нейрогормональная система в реализации стресса.
Изменение ее функции под влиянием различных факторов, в том числе инфекционных, приводит к нарушениям электролитного обмена с избыточным выведением через почки К+, Мg2+ и развитием гипокалиемии и гипомагниемии, как правило, в виде сочетанного дисбаланса [7].
Патогенетическая концепция развития астении при COVID-19 связана, в частности, с особенностями самого вируса.
Вирус SARS-CoV-2 тропен к рецепторам ангиотензинпревращающего фермента 2 (АПФ2), широко представленным на клетках эндотелия сосудов, вызывает развитие эндотелиита с увеличением проницаемости сосудистой стенки, обменные нарушения, что способствует длительному персистированию астении и когнитивных нарушений на фоне COVID-19.
В условиях эндотелиальной дисфункции повышенный синтез тромбоксана увеличивает агрегационные свойства тромбоцитов, приводя к снижению церебральной перфузии вследствие нарушения микроциркуляции, что также может вносить вклад в патогенез астении и когнитивных нарушений [4].
F. Silhol et al. [8] предполагают у пациентов с COVID-19 избыточную активацию ренин-ангиотензин-альдостероновой системы (РААС).
При проникновении коронавируса SARS-CoV-2 в клетки-мишени посредством АПФ2 уменьшается количество последнего на их поверхности, что сопровождается нарушением клиренса ангиотензина II и избыточной секрецией альдостерона и ведет к развитию гипокалиемии вследствие чрезмерного выведения калия почками [8].
Причинами гипокалиемии у пациентов с COVID-19 могут быть и повышенные потери калия в желудочно-кишечном тракте вследствие рвоты и диареи [9].
Свой вклад в развитие электролитных нарушений могут также вносить лекарственные средства, применяемые на основании временных рекомендаций по лечению коронавирусной инфекции, в частности глюкокортикостероиды (ГКС) и антибактериальные препараты.
ГКС вызывают гипокалиемию путем активации Na+/K+-АТФазы в скелетных мышцах и перемещения экстрацеллюлярного калия внутрь клеток [10]. По данным H.S. Rehan et al.
[11], антибактериальные препараты являлись причиной ятрогенной гипокалиемии в 47,5% случаев, наиболее часто — цефтриаксон (24,5%) и азитромицин (10,5%).
Роль калия и магния в поддержании гомеостаза организма
Прежде чем говорить о ПИАС и сопряженных с ним нарушениях электролитного баланса, хотелось бы коротко остановиться на основных эффектах калия и магния.
Калий — внутриклеточный микроэлемент, необходимый для нормального функционирования клеток, поддержания кислотно-щелочного и электролитного баланса, общего объема жидкости, обеспечения нервно-мышечной возбудимости и проводимости [12].
Являясь вазоактивным ионом, калий способствует улучшению кровотока вследствие гиперполяризации мембран клеток гладкой мускулатуры и вазодилатации.
Ионы калия, высвобождаясь из эндотелиальных клеток, участвуют в процессе эндотелийзависимой релаксации сосудов [13, 14], способствуя снижению уровня артериального давления [15] и риска развития инсульта [16]. Калий участвует в регуляции уровня глюкозы крови, индуцируя потенциал-зависимую секрецию инсулина [17].
В норме содержание калия в клетке составляет 150–160 ммоль/л, в плазме крови — 3,5–5,5 ммоль/л. Суточная потребность в калии составляет 2500 мг. Уровень калия внутри и вне клетки регулируется натрий-калиевым насосом [18]. Причем нормальное функционирование Na+-К+-АТФазного мембранного насоса, активируемого ферментом Na+-К+-АТФазой, обеспечивают ионы магния [19].
Магний влияет на процессы образования молекул АТФ и адекватную работу трансмембранного ионного насоса через участие в рецепторных образованиях, поддерживающих процессы окислительного фосфорилирования в митохондриях клеток [20].
Ионы магния принимают участие в трансмембранном переносе ионов кальция, что определяет, в частности, электрическую стабильность миокарда [21]. Действуя как естественный блокатор кальциевых каналов, магний оказывает гипотензивный эффект [22–24]. При этом комбинация магния с калием усиливает антигипертензивное действие [25].
Магний — важный кофактор, принимающий участие в синтезе простагландина E1 — мощного вазодилататора и ингибитора агрегации тромбоцитов [26]. При участии ионов магния реализуется мышечная и нейрональная деятельность, осуществляется передача сигнала в тканях, обладающих электрической активностью, происходит синтез белков [21].
Нормы содержания магния в крови в среднем составляют 0,65–1,05 ммоль/л, что представляет собой очень небольшую (0,3%) часть общего фонда данного иона в теле человека [21].
Таким образом, калий и магний — чрезвычайно важные микроэлементы, принимающие участие в поддержании гомеостаза и адаптации организма как в норме, так и при различных патологических состояниях [12].
Коронавирусная инфекция, дефицит электролитов и постковидный астенический синдром
Новая коронавирусная инфекция COVID-19 в 5–20% случаев протекает с развитием двусторонней пневмонии, которая может сопровождаться острым респираторным дистресс-синдромом и требовать госпитализации [27, 28].
У госпитализированных пациентов в качестве частого электролитного нарушения выявляется гипокалиемия, распространенность которой достигает 20% [29].
В исследовании, целью которого было непосредственное изучение гипокалиемии в условиях стационара у пациентов с COVID-19, данное нарушение выявлялось в 61,7% случаев [30]. По данным А.И. Циберкина и cоавт.
[31], у 37,2% больных COVID-19, госпитализированных в стационар с пневмонией, определялась гипокалиемия (К+ менее 3,5 ммоль/л).
Для этих пациентов были характерны более высокие уровни С-реактивного белка и лактатдегидрогеназы, более низкая сатурация О2 и значимо больший объем поражения легких по данным КТ на момент поступления в стационар. У них выявлялись более высокие уровни pH венозной крови в сравнении с пациентами без нарушений обмена К+: 7,46 (7,44–7,47) ммоль/л и 7,35 (7,31–7,39) ммоль/л соответственно. Вопрос, является ли алкалоз следствием гипокалиемии или возникает с развитием легочной недостаточности, требует дальнейшего изучения.
D. Chen et al.
[30] в своей работе также выявили зависимость выраженности неспецифических лабораторных показателей воспаления, изменения легких на компьютерной томограмме от уровня калия и высказали предположение, что степень гипокалиемии и активность вирусной инфекции находятся в прямой корреляции и что регресс электролитных нарушений является благоприятным прогностическим признаком в отношении заболевания [30]. В ходе ретроспективного когортного исследования с участием 306 пациентов с пневмонией на фоне коронавирусной инфекции, госпитализированных в академический центр Университета Аликанте, установлено, что среди пациентов с нормокалиемией лишь 9% требовали госпитализации в отделение интенсивной терапии, тогда как из пациентов с легкой гипокалиемией госпитализированы были 30,3%, а с тяжелой гипокалиемией — 33,3%. Инвазивной механической вентиляции легких требовали 6,2, 25 и 33,3% пациентов, а средняя продолжительность пребывания в отделении интенсивной терапии составила 7, 11 и 16,5 дня соответственно. Как показали результаты исследования, гипокалиемия независимо связана с необходимостью инвазивной механической вентиляции легких у госпитализированных пациентов [32]. Уровень калия менее 3,5 ммоль/л у пациентов с коронавирусной инфекцией также ассоциирован с увеличением смертности от всех причин и сердечно-сосудистой смертности [33, 34]. По данным Национальной комиссии здравоохранения Китая, среди лиц, умерших от COVID-19, около 12% не имели ранее сердечно-сосудистого заболевания, но при этом у них определялся повышенный уровень сердечного тропонина I (hs-cTnI) или была остановка сердца во время госпитализации [35].
Гипокалиемия и гипомагниемия, в свою очередь, могут стать причиной развития резистентных к лекарственной терапии нарушений ритма, особенно у больных с заболеваниями сердечно-сосудистой системы, поскольку в условиях дефицита АТФ и нарушения функции калий-натриевого насоса при дистрессе отмечается избыточное проникновение в кардиомиоциты ионов натрия и кальция.
Неспецифическое учащенное сердцебиение было общим проявлением вирусной инфекции у 7,3% пациентов с COVID-19, у 16,7% отмечалась аритмия [36], которая, возможно, обусловлена воспалительными, нейрогормональными изменениями, гипоксией, нарушениями метаболизма и гипокалиемией. Около 10% пациентов с COVID-19 были переведены в отделение интенсивной терапии из-за аритмии [37].
Кардиоповреждающее действие гипокалиемии проявляется характерными изменениями на ЭКГ в виде удлинения QТ, снижения сегмента SТ, депрессии или инверсии зубца Т, появления зубца U. Прослеживается корреляция между выраженностью гипокалиемии и характером нарушений ритма. Так, при уровне калия ~3,0–3,8 ммоль/л возможна желудочковая экстрасистолия, а выраженная гипокалиемия (
Чудо или миф? (Исследование мелатонина) | Арендт | Проблемы Эндокринологии
Сегодня о мелатонине говорят, пожалуй, больше, чем о любом другом гормоне. Его считают чуть ли не панацеей от всех болезней, источником молодости; по объему продаж в США он в настоящее время конкурирует с витамином С и аспирином.
К сожалению, роль мелатонина чрезмерно преувеличена, и претензии в значительной степени необоснованы или подкрепляются лишь данными, полученными в опытах на животных [1, 2].
Для уточнения механизма действия этого гормона и его взаимосвязи с физиологической хронобиологией необходимо провести гораздо больше исследований.
В частности, еще предстоит определить наиболее оптимальные время назначения и дозировку мелатонина для людей, позволяющие добиться максимального воздействия этого препарата на циркадный ритм человека и на множество функций, зависимых от него.
Мелатонин (ТЧ-ацетил-5-метокситриптамин) был открыт Ароном Лернером с сотрудниками в 1958 г. В то время группа Лернера была занята поисками в шишковидной железе фактора, осветляющего кожу [3]. Для получения нескольких микрограммов чистого материала было обработано много тысяч желез.
Мелатонин оказался самым мощным из факторов, когда-либо исследованных на культурах клеток пигментированной кожи лягушек.
Во избежание неправильного понимания хотелось бы пояснить, что, хотя меланофоры низших позвоночных чувствительны к мелатонину, они отличаются от пигментных клеток млекопитающих, и практически нет доказательств какой-либо осветляющей кожу активности у людей.
Мелатонин является основным гормоном, секретируемым шишковидной железой — крошечным органом, расположенным в промежуточном мозге и соединенным со светочувствительной системой у млекопитающих.
У всех исследованных к настоящему времени видов мелатонин в норме синтезируется и высвобождается во время темной фазы суток. Таким образом, имеется очевидная связь со сном у видов, ведущих дневной образ жизни, таких, какими являются люди.
Однако у ночных грызунов самые высокие уровни мелатонина наблюдаются в период их активности.
Поскольку мелатонин вырабатывается в темное время суток, его содержание отражает продолжительность ночи (а следовательно, и продолжительность дня). Его первичной физиологической функцией является доведение информации, касающейся суточного прохождения времени, до уровня жизнедеятельности организма.
Длительная продолжительность секреции мелатонина свидетельствует о длинных ночах, а короткая — о коротких. Суточный ритм освещения (фотопериод) и меняющаяся продолжительность дня являются нашими самыми точными ориентирами времени, связанными с окружающей средой.
Они лежат в основе организации физиологических и поведенческих функций, которые реагируют на изменения сезонных и циркадных (т. е. суточных) ритмов, таких как сон, бодрствование и внутренняя температура. У человека функции, на которые влияет продолжительность дня и интенсивность света, скорее всего изменяются под воздействием мелатонина.
Именно потому, что мелатонин влияет на множество систем организма, можно говорить о потенциальной опасности недифференцированного применения гормона в качестве универсальной панацеи.
Ритм секреции мелатонина генерируется эндогенно
Мелатонин синтезируется из триптофана посредством ацетилирования и последующего О-метилирования серотонина. В организме человека практически весь циркулирующий мелатонин выделяется из шишковидной железы.
Небольшое его количество синтезируется в других участках, таких как сетчатка, которая в последнее время привлекает все большее внимание ученых.
С другой стороны, секрецию мелатонина можно подавить с помощью p-адренергических антагонистов.
Ежедневный ритм секреции генерируется в головном мозге и в отсутствие ориентиров времени сохраняет свою периодичность в диапазоне около 24 ч, что характерно для истинного циркадного ритма.
Достаточно яркий свет синхронизирует ритм до 24 ч и в то же время подавляет выработку мелатонина ночью, устанавливая таким образом специфическую продолжительность его секреции в соответствии с продолжительностью дня [3].
На основе этого наблюдения была сделана попытка лечить ярким светом зимнюю депрессию, хотя, как ни странно, нет убедительных доказательств, свидетельствующих о причастности мелатонина к возникновению этого расстройства.
Когда циклическая смена света/темноты и других ориентиров времени ускоряется или замедляется (например, после перелета через временные пояса или при сменной работе), циркадная система медленно адаптируется к новому положению фаз.
В процессе адаптации эндогенные ритмы не совпадают по фазе с внешней окружающей средой и иногда — друг с другом. Считается, что это вызывает многие заболевания и функциональные расстройства у сменных рабочих и путешественников, перелетающих через временные пояса.
Кроме того, нарушение циркадных ритмов характерно для слепых, лиц пожилого возраста и некоторых психически больных.
Физиологические количества мелатонина оказывают воздействие на синхронизацию репродуктивных функций у видов, зависимых от дневного света [3]. Например, у зародышей и новорожденных млекопитающих этот гормон помогает запрограммировать циркадную систему и определяет время начала и окончания стадий развития организма, особенно полового созревания.
С другой стороны, хотя у европейцев действительно наблюдается колебание частоты зачатий (наивысшее увеличение весной и небольшой всплеск осенью), его зависимость от уровня содержания мелатонина не выяснена.
Мелатонин оказывает в основном подавляющее воздействие на репродуктивную функцию человека, и путем введения достаточно высокой дозы (80—300 мг в день) можно частично подавить пик лютеинизирующего гормона. Мелатонин был исследован в качестве противозачаточного средства в комбинации с минитаблеткой прогестина [4].
Однако если учесть, что гораздо более низкие дозы (< 10 мг) оказывают сильное влияние на ритмические функции организма, использование этих больших количеств потенциально опасно.
Было доказано, что мелатонин и шишковидная железа не играют существенной роли в поддержании циркадных ритмов у млекопитающих в нормальной окружающей среде, однако введение мелатонина в определенное время действительно сдвигает циркадные ритмы [3].
Первым человеком, испытавшим на себе действие нового гормона, был сам Арон Лернер.
В 1960-е годы некоторые пациенты участвовали в исследовании последствий приема больших доз мелатонина (до 1,5 г), которые вызвали у них сонливость и спазмы мышц живота [3].
Мелатонин в низких дозах оказывает на человека внезапное легкое ’’снотворное” воздействие и вызывает изменения электроэнцефалограммы, аналогичные, но не идентичные изменениям, вызываемые бензодиазепинами [5, 6]. Предполагалось, что очень низкие, «физиологические” дозы мелатонина (0,3 мг) благотворно влияют на сон, но поступавшие сообщения были противоречивы, и в некоторых случаях отмечалось нарушение сна [7].
При приеме в спокойной обстановке, в затемненном помещении мелатонин в дозе 1 — 10 мг быстро снимает напряжение, вызывает сонливость, затормаживает некоторые функции и снижает температуру тела в зависимости от дозы [8].
Вечерний прием провоцирует фазовое ускорение циркадных ритмов, а утренний может вызвать фазовое замедление [3]. Яркий свет и мелатонин оказывают сильное, но противоположно направленное воздействие на внутреннюю температуру тела.
На основе этих, а также ряда других наблюдений была создана теория, согласно которой вызываемый мелатонином циркадный фазовый сдвиг и сонливость опосредованы изменениями внутренней темпратуры.
Представляется, что благодаря этим свойствам мелатонин, вводимый в подходящем режиме, является перспективным способом лечения нарушений циркадных ритмов.
Можно будет также оказывать помощь при таких состояниях, как бессонница пожилых людей (возможно, связанная со снижающейся выработкой мелатонина), затрудненное засыпание и раннее пробуждение.
У многих горожан нередко отсутствуют четкие временные ориентиры, а среди людей, проживающих в умеренной и полярной зонах, наблюдается сильная тенденция к замедлению ритма циркадной системы зимой (в условиях недостаточного освещения).
Мелатонин может широко использоваться для ’’синхронизации” желаемого времени сна с внешней циркадной фазой. Факты коррекции фазового замедления в зимнее время могут служить объяснением всех разрозненных сообщений об «улучшении самочувствия и сна при лечении мелатонином”.
Нарушение циркадного ритма при перелете через временные пояса и сменной работе
Когда вы летите в восточном направлении, вам необходимо ускорить циркадные ритмы, а путешествуя на запад — замедлить их.
Однако индивидуальное время начала лечения, предназначенного для ускорения или замедления хода биологических часов, может быть определено только тогда, когда известно положение циркадной фазы человека. По этой причине очень трудно лечить пилотов сверхдальних рейсов, которые постоянно пересекают временные пояса.
Обычные путешественники с успехом используют мелатонин для облегчения состояния, вызванного нарушением циркадных ритмов при перелете через временные пояса.
Исследования показывают, что самостоятельная оценка в баллах действительных нарушений циркадных ритмов при перелете через временные пояса может быть снижена в среднем на 50%. В то же время в имитационных исследованиях наблюдалось субъективное улучшение сна, активности, настроения и работоспособности (сообщения о воздействии на сон были довольно противоречивыми) [3, 8].
Имеется очень мало опубликованных работ об использовании мелатонина сменными рабочими. Любые воздействия этого препарата на работоспособность человека требуют тщательного изучения.
Например, не всегда желательна адаптация циркадной системы при быстром чередовании смен, поскольку нарушаются сон и активность в дни отдыха. В этих случаях острые эффекты мелатонина могут быть более полезны, чем его способность сдвигать циркадные фазы.
В двух отчетах о полевых исследованиях сообщалось об улучшении сна и некоторой адаптации циркадных ритмов [8].
Нарушения сна
Некоторые слепые люди, ведущие в целом нормальную жизнь, страдают от нарушения ритма сна и бодрствования. В недавно проведенном исследовании 58% обследованных жаловались на расстройство сна [9].
Когда их биологические часы не совпадают по фазе с окружающей средой, у них периодически возникают нарушения, в частности они испытывают сонливость и снижение работоспособности в дневное время и плохо спят ночью. Многие переносят это состояние очень тяжело.
До настоящего времени обследовано лишь небольшое число лиц, но на большинство из них введение мелатонина оказало некоторое благоприятное воздействие, которое заключалось главным образом в стабилизации засыпания.
Кроме того, хорошие результаты дало лечение мелатонином детей с множественными расстройствами, преимущественно старадающих нарушениями зрения, поведения и сна [3, 8].
Вечерний прием мелатонина (5 мг) ускоряет время наступления сна у пациентов с синдромом задержки фазы сна, которые не могут заснуть до раннего утра [3].
В ряде предварительных сообщений описаны случаи улучшения сна у лиц пожилого возраста, что было отнесено на счет влияния замещения низкоамплитудного мелатонина его более ’’юношескими” концентрациями [10].
Представляется, что это, по крайней мере частично, можно объяснить оптимизацией циркадных зависимостей путем усиления стимулов во время пробуждения. Небезуспешными были попытки применения высоких фармакологических доз мелатонина при лечении ’’хронической бессонницы”.
Иммунная функция, «тушение» свободных радикалов и рак
Шумиха, поднятая в последнее время вокруг мелатонина, была связана с его возможностями в плане предотвращения рака и старения [1—3]. Сообщалось, что этот гормон подавляет рост ряда экспериментально вызванных опухолей и клеточных линий in vitro.
Однако далеко не во всех исследованиях были получены положительные результаты; например, в определенные фотопериоды мелатонин стимулировал рост меланомы у хомяков. Фармакологические дозы мелатонина могут оказывать стимулирующее воздействие на некоторые элементы иммунной системы.
Некоторый оптимизм внушают предварительные результаты комбинированного применения мелатонина и тамоксифена или интерлейкина. Полностью отсутствуют данные о возможном использовании мелатонина при лечении СПИДа.
В ряде работ сообщалось об антиоксидантной функции мелатонина [1—3]. Утверждалось, что он представляет собой самый мощный известный нейтрализатор гидроксильных ионов, который защищает ДНК и другие системы от окислительного повреждения.
На сегодняшний день известно, что большие дозы мелатонина оказывают некоторое воздействие на животных, но данных о воздействии на людей нет.
Более того, имеются серьезные доказательства того, что мелатонин (опятьтаки в больших дозах) может усиливать вызванное светом поражение сетчатки у крыс, предположительно вследствие прооксидантного воздействия.
Еще большие надежды возлагали на предполагаемую эффективность мелатонина в качестве средства против старения [1—3].
Основой этих представлений послужили опыты, проведенные с серьезными нарушениями на линиях мышей с генетической неспособностью вырабатывать мелатонин.
Никаких данных о продлении молодости у людей не существует, и трудно представить, как можно провести какие-либо должным образом контролируемые испытания в этой области.
Планы на будущее и перспективы
Наряду с оптимизацией дозы, композиции и времени введения мелатонина необходима соответствующая оценка его безопасности.
Такие проблемы, как продолжительность действия, взаимодействие с другими лекарственными препаратами, применение во время беременности и воздействие на половое созревание у людей, еще недостаточно изучены.
При оральном введении мелатонин имеет очень короткий период полувыведения; наблюдаются также огромные индивидуальные различия его фармакокинетики [3].
Действительно, у одних людей имеются очень низкие естественные концентрации мелатонина, в то время как у других эти величины в 100 раз превышают нормальный уровень. Некоторые из уже обнаруженных противоречивых и разрушительных воздействий мелатонина могут быть обусловлены этой индивидуальной метаболической изменчивостью и(или) трудностями определения оптимального времени введения.
Существует вероятность того, что при неправильном определении времени введения мелатонина он может оказать неблагоприятное воздействие на многие системы, включая скорость неврологических процессов. Тем не менее мелатонин является одним из самых перспективных открытий последнего времени.
Современные исследования включают разработку ряда аналогов, действие которых будет более стабильным.
Помимо этого, было проведено клонирование рецепторов мелатонина, что открывает новые горизонты исследовательских возможностей и привлекает еще большее внимание к этому многогранному биологическому веществу.