Наночастицы могут преодолевать гематоэнцефалический барьер и доставлять лекарства в мозг, — пишет eurekalert.org.
Исследователи из Национального института научных исследований (INRS) показали, что наночастицы можно использовать для доставки лекарств в мозг для лечения нейродегенеративных заболеваний.
Гематоэнцефалический барьер является основным препятствием при лечении нейродегенеративных заболеваний, таких как болезнь Альцгеймера и Паркинсона.
Согласно недавнему исследованию, проведенному Жаном-Мишелем Рабанелем, исследователем с докторской степенью под руководством профессора Чарльза Рамассами, наночастицы с особыми свойствами могут преодолевать этот барьер и захватываться нейронными клетками.
Исследователи уверены, что эти результаты откроют важные перспективы для попадания лекарств прямо в мозг. Это открытие позволит улучшить лечение нейродегенеративных заболеваний, от которых страдают более 565 000 канадцев, в том числе 141 000 жителей Квебека.
«Гематоэнцефалический барьер отфильтровывает вредные вещества, чтобы предотвратить их свободное попадание в мозг. Но этот же барьер также блокирует прохождение лекарств», — объясняет фармаколог Чарльз Рамассами.
Обычно для попадания небольшого количества препарата в мозг требуются высокие дозы. То, что остается в кровотоке, имеет серьезные побочные эффекты. Часто этот дискомфорт заставляет пациента прекращать лечение.
«Использование наночастиц, которые инкапсулируют лекарства, привело бы к меньшему количеству побочных эффектов при одновременном повышении эффективности мозга».
Эффективность на животной модели
Чтобы доказать эффективность этого метода, исследовательская группа сначала проверила его на культивируемых клетках, а затем на рыбках данио. «Этот вид имеет несколько преимуществ.
Его гематоэнцефалический барьер аналогичен гематоэнцефалическому барьеру человека, а его прозрачная кожа позволяет видеть распределение наночастиц почти в реальном времени», — говорит профессор Рамассами, заведующий кафедрой исследований Луизы и Андре Чаррон Болезнь Альцгеймера от Fondation Armand-Frappier.
Используя тесты in vivo, исследователи смогли наблюдать пересечение гематоэнцефалического барьера. Они также подтвердили отсутствие токсичности в библиотеке выбранных наночастиц. «Мы создали частицы из полимолочной кислоты (PLA) — биосовместимого материала, который легко удаляется организмом.
Слой полиэтиленгликоля (PEG) покрывает эти наночастицы и делает их невидимыми для иммунной системы, чтобы они могли дольше циркулировать в организме», — поясняет он.
После нескольких лет исследований эффективных и безопасных наночастиц исследовательская группа продолжит лабораторные испытания, нацеленные на доставку активных ингредиентов другим моделям животных с максимальным клиническим применением.
[ eurekalert.org]
Информация предоставлена Информационным агентством «Научная Россия». Свидетельство о регистрации СМИ: ИА № ФС77-62580, выдано Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций 31 июля 2015 года.
В вашем браузере отключен JavaScript. Будет показана упрощенная версия сайта, в которой могут отсутствовать многие функции.
Прямо в мозг: препятствия и способы их преодолеть
Статья на конкурс «Био/Мол/Текст»: В ходе работы мы выяснили механизм проникновения наночастиц из носовой полости в мозг, минуя гематоэнцефалический барьер (ГЭБ). Для этого были использованы наночастицы оксида марганца (Mn3O4), которые визуализировались при томографии.
На данный момент описано несколько возможных путей транспорта веществ из носовой полости в мозг, но точный механизм еще не определен. Чтобы увидеть, как именно наночастицы проникают в мозг, проводились серии экспериментов по блокированию захвата/транспорта наночастиц в нейронах; проверялась и гипотеза транспорта по внеклеточному пространству.
Актуальность данной работы — выявление путей доставки лекарственных препаратов и изучение проникновения вирусов в мозг в обход ГЭБ.
Фаворит Российского научного фонда в номинации «Своя работа» конкурса «Био/Мол/Текст»-2020/2021.
Партнер номинации — Российский научный фонд.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
«Книжный» спонсор конкурса — «Альпина нон-фикшн»
В организме человека существует специальная система защиты мозга от проникновения в него крупных молекул, в том числе инфекционных агентов — это гематоэнцефалический барьер (ГЭБ). Давайте подробнее рассмотрим его структуру (рис. 1). Первая линия защиты — плотный стой эндотелия капилляров, соединенных плотными контактами.
В отличие от большинства капилляров тела, в них нет крупных щелей (пор) для прохождения некоторых белков плазмы [1]. Далее на пути к мозгу находятся перициты (клетки соединительной ткани) и астроциты (вспомогательные клетки в нервной ткани), которые механически не позволяют пройти молекулам крупнее определенного размера.
Гематоэнцефалический барьер не пропускает вещества более 400–500 Да по массе, в зависимости от свойства вещества. (Для сравнения, сывороточный альбумин человека, самый распространенный белок в крови, имеет массу 65 000 Да).
Также барьер непроницаем для ионов, но пропускает жирорастворимые вещества, воду, кислород, углекислый газ, некоторые обезболивающие и алкоголь (рис. 1).
Рисунок 1. Схема строения гематоэнцефалического барьера.
Э — клетки капилляров, соединенные плотными контактами; A — вещества, не проникающие через ГЭБ; B — вещества, проникающие через ГЭБ каким-либо способом, описанным ниже. Стрелками обозначены белковые системы транспорта веществ внутрь клетки и из нее.
Таким образом, долгое время считалось, что мозг полностью защищен от проникновения некоторых веществ из крови, пока не было обнаружено возможности прохода через ГЭБ.
Такой способ доставки нужен прежде всего для доставки лекарств в нервную систему, поэтому было важно найти способы преодолеть барьер: ослабить клеточные контакты эндотелия (клеточного слоя) капилляров мозга, использовать системы транспорта веществ через мембрану капилляров или проникнуть в мозг с помощью эндоцитоза [2].
У данных способов есть свои недостатки, например, разрушение плотных контактов эндотелия приводило к местному накоплению веществ в мозге, повышению внутричерепного давления и требовало значительного времени на восстановление барьера [3]. Использование систем транспорта растворимых в воде метаболитов для доставки действующего вещества в мозг накладывает ограничения на само вещество.
В данном случае оно должно либо имитировать «привычный» для данного белка-транспортера метаболит клетки, либо связываться с метаболитом для прохождения через мембрану [4].
Транспорт веществ путем эндоцитоза (захвата внешнего материала) клетками эндотелия тоже имеет свои недостатки — неспецифический эндоцитоз сведен к минимуму в капиллярах мозга, а специфический эндоцитоз часто включает в себя частичное пропускание вещества.
Например, при доставке ионов железа посредством белка ферритином этот белок связывается с рецептором на эндотелии капилляра, проникает в клетку, высвобождает ионы железа для их дальнейшего транспорта в мозг, а потом удаляется из клетки обратно в просвет капилляра [5]. У всех перечисленных выше способов есть общий нюанс — вещество попадает в мозг через кровь, а значит, вещество распределяется равномерно по всему организму, поэтому нужно учитывать его системный эффект. Это накладывает дополнительные ограничения и увеличивает время испытания нового лекарства. В последние десятилетия ученые пытались преодолеть барьер и доставить лекарства с помощью наночастиц, введенных в кровь [6–8].
Наночастицы — собирательное название для группы веществ размером от 1 до 1000 нм. Они могут иметь различаться по форме и своим свойствам, в зависимости от пути преодоления ГЭБа. Это могут быть различные полимеры, натуральные или синтетические, или металлические частицы.
Однако пока что наночастицы показывают не лучшие результаты в качестве транспортеров лекарств через барьер, если их вводить в кровь, а способ их проникновения через барьер — все еще спорный вопрос [9].
Как отметил Франческо Элдро, было потрачено много времени на изменение (модификацию) действующих веществ в составе лекарств для преодоления барьера, но гораздо меньше изучали способы их проникновения в мозг [10], [11].
Существуют способы проникнуть в нервную систему, даже минуя стадию попадания в кровь. Конечно, можно просверлить отверстие в черепе и ввести вещество иглой через барьер — это довольно эффективный способ преодолеть ГЭБ.
Единственный недостаток в том, что введенное вещество практически не распространяется по мозгу [12]. Но есть и гораздо менее инвазивный вариант — проникнуть в мозг через носовую полость в обход ГЭБа. Рассмотрим, почему этот способ вызывает особый интерес у ученых.
Вспомним строение обонятельной системы позвоночных на примере мыши (рис. 2). В носовой полости есть специальный участок скопления рецепторных окончаний нейронов — обонятельный эпителий.
От дендритов сигнал проходит через тело, транспортируется по аксону и передается митральной клетке, входящей в состав обонятельной луковицы; место передачи называется синапсом.
Рисунок 2. Строение обонятельной системы.
(a) — строение обонятельной системы мыши в разрезе. ОЭ — обонятельный эпителий, ОЛ — обонятельная луковица, ЛОТ — латеральный обонятельный тракт.
(б) — cтроение обонятельной луковицы мыши. АК) — аксоны обонятельных рецепторов, ГС — гломерулярный слой, МС — митральный слой, 1 и 2 — внешний и внутренний плексиформные слои обонятельной луковицы.
Тела митральных клеток образуют митральный слой, а аксоны этих клеток формируют латеральный обонятельный тракт. По нему передается информация о запахах в центры головного мозга, которые обрабатывают сигнал. Из-за «доступности» такого способа попадания в мозг, который вдобавок не требует серьезных ограничений по структуре и размерам веществ, данная тема требует более подробного анализа.
Данная работа посвящена изучению процесса проникновения наночастиц в головной мозг через носовую полость.
Этот путь актуален не только с точки зрения доставки лекарственных препаратов, но и с точки зрения изучения процесса проникновения вирусов в головной мозг.
У всех сейчас на слуху специфический симптом коронавирусной инфекции — потеря обоняния, что свидетельствует о возможности неспецифического проникновения любого вещества в нашу нервную систему.
Описание эксперимента и результаты
Для более точной визуализации транспорта веществ в мозг через носовую полость мы использовали наночастицы оксида марганца (Mn3O4, диаметр ~34 нм). Введя их в одну ноздрю мыши, можно увидеть положение наночастиц при томографии (рис. 3).
Рисунок 3. Томограмма обонятельной луковицы мыши.
(a) — распределение МРТ сигнала по слоям обонятельной луковицы (MOB): гломерулярному слою (GL), наружному плексиформному слою (EPL), слою митральных клеток (ML), слою зернистых клеток (GrL) спустя 24 часа после введения Mn3O4-наночастиц в правую ноздрю. Интенсивность сигнала выделена с помощью псевдоокрашивания (компьютер окрашивает изображение в различные цвета в зависимости от интенсивности МРТ-сигнала).
(б) — снимок в присутствии (LTT) и отсутствии (vehicle) ингибитора пресинаптической активности нейрона. Белыми стрелками показаны слои: гломерулярный слой (GL) и слой митральных клеток (ML).
В ходе работы было проанализировано влияние различных ингибиторов на захват и транспорт наночастиц в головной мозг мыши для ответа на основной вопрос: наночастицы проходят из носовой полости по нейронам или они попадают в нервную систему через внеклеточное пространство [13].
Чтобы проследить путь наночастиц из обонятельного эпителия в обонятельную луковицу, были использованы специфические и неспецифические ингибиторы эндоцитоза, а также вещества, разрушающие плотные контакты клеток обонятельного эпителия.
Отличия между ингибиторами эндоцитоза в том, что специфические ингибиторы блокируют захват клетками определенного вещества, а неспецифические снижают общую способность клеток к эндоцитозу. Исходя из полученных данных, мы заключили, что частицы поглощаются клетками ольфакторного эпителия, а не проходят между ними.
Также можно сделать вывод, что захват наночастиц происходит без сопряжения с каким-либо веществом, так как специфические ингибиторы эндоцитоза не влияли на уровень МРТ-сигнала.
Чтобы проследить дальнейший путь наночастиц, мы использовали ингибиторы аксонального транспорта (колхицин, лидокаин).
Колхицин блокирует перемещение грузов от тела нейронов до синапса; лидокаин подавляет проведение импульсов в нейронах вследствие блокирования натриевых каналов (поэтому наночастицы, попав в нейрон, не могут передаваться дальше в синапс).
Оба ингибитора достоверно повлияли на транспорт Mn3O4-наночастиц из носовой полости в мозг. Таким образом, мы показали, что Mn3O4-наночастицы проникают в обонятельную луковицу через аксон, а их транспорт зависит от активности нейрона.
Продолжая двигаться в мозг с наночастицами, мы попадаем во внешний слой обонятельной луковицы. Здесь наночастицы стоят перед выбором: либо идти через синапс в следующий нейрон и дальше транспортироваться по латеральному обонятельному тракту, либо перемещаться через межклеточное пространство.
Понять это возможно посредством влияния блокаторов. Ингибиторы пре- и постсинаптической активности нейронов влияют лишь на стадию транспорта наночастиц из обонятельной луковицы (MOB) в латеральный обонятельный тракт (LOT). Причем значительное влияние оказывают только ингибиторы пресинаптической активности — баклофен и LTT (левитриацетам).
Такой эффект появляется из-за того, что наночастицы не работают как нейромедиаторы. Чтобы вызвать у нейрона постсинаптическую активность, вещество должно связаться с рецептором на поверхности нейрона и вызвать появление потенциала действия в нем (передать сигнал дальше по нервной цепочке).
Наночастицы не могут связываться со специфическими рецепторами; они попадают в следующий нейрон за счет неспецифического эндоцитоза. Из-за этого ингибиторы постсинаптической активности практически никак не влияют на транспорт наночастиц из обонятельной луковицы в латеральный обонятельный тракт.
Поэтому можем сделать вывод: наночастицы передаются транссинаптически по структурам головного мозга, отвечающим за обоняние в обход ГЭБ.
Обсуждение
Таким образом, на примере магнитных наночастиц мы показали, что возможен транспорт частиц из носа в мозг в обход ГЭБ внутри нейрональных клеток. Более того, процесс назального транспорта частиц зависит от активности нейронов.
Так как данные наночастицы схожи по размерам и другим физическим свойствам с респираторными вирусами, можно предположить что транспорт вирусов в нервную систему возможен не только путем проникновения через ГЭБ [14].
Таким образом, найденный способ транспорта наночастиц в обход ГЭБ дает основу для исследования передачи вирусных заболеваний этим путем, а также для создания новых противовирусных препаратов. Особой актуальностью обладает исследование транспорта SARS-CoV-2, так как одним из симптомов коронавирусной инфекции является потеря вкуса и обоняния.
Заключение
Итогом работы стало подтверждение гипотезы о том, что наночастицы транспортируются через нейроны в головной мозг, а не через межклеточное пространство.
Также мы можем сказать, что они не только захватываются обонятельными рецепторами, но и проходят через синапс в митральную клетку обонятельной луковицы, после чего по латеральному обонятельному тракту транспортируются в головной мозг.
Понимание точного механизма транспорта веществ в обход ГЭБ может значительно упростить создание лекарственных препаратов против известных заболеваний — болезни Паркинсона и болезни Альцгеймера, а также поможет расширить представление о способах проникновения вирусов в нервную систему человека.
- Гайтон Артур К., Холл Джон Э. Медицинская физиология. Логосфера, 2008. — 857 с.;
- Yan Zhang, Donald W. Miller. (2005). Pathways for Drug Delivery to the Central Nervous System. Drug Delivery. 29-56;
- Marc-André Bellavance, Marie Blanchette, David Fortin. (2008). Recent Advances in Blood–Brain Barrier Disruption as a CNS Delivery Strategy. AAPS J. 10, 166-177;
- Yasuo Uchida, Sumio Ohtsuki, Yuki Katsukura, Chiemi Ikeda, Takashi Suzuki, et. al.. (2011). Quantitative targeted absolute proteomics of human blood-brain barrier transporters and receptors. Journal of Neurochemistry. 117, 333-345;
- Wilfred A. Jefferies, Malcolm R. Brandon, Simon V. Hunt, Alan F. Williams, Kevin C. Gatter, David Y. Mason. (1984). Transferrin receptor on endothelium of brain capillaries. Nature. 312, 162-163;
- Cláudia Saraiva, Catarina Praça, Raquel Ferreira, Tiago Santos, Lino Ferreira, Liliana Bernardino. (2016). Nanoparticle-mediated brain drug delivery: Overcoming blood–brain barrier to treat neurodegenerative diseases. Journal of Controlled Release. 235, 34-47;
- Luca Bors, Franciska Erdő. (2019). Overcoming the Blood–Brain Barrier. Challenges and Tricks for CNS Drug Delivery. Sci. Pharm.. 87, 6;
- Débora Braga Vieira, Lionel Fernel Gamarra. (2018). Multifunctional Nanoparticles for Successful Targeted Drug Delivery across the Blood-Brain Barrier. Molecular Insight of Drug Design;
- Jean-Christophe Olivier. (2005). Drug transport to brain with targeted nanoparticles. Neurotherapeutics. 2, 108-119;
- Franciska Erdő, Luca Anna Bors, Dániel Farkas, Ágnes Bajza, Sveinbjörn Gizurarson. (2018). Evaluation of intranasal delivery route of drug administration for brain targeting. Brain Research Bulletin. 143, 155-170;
- Dhrisya Chenthamara, Sadhasivam Subramaniam, Sankar Ganesh Ramakrishnan, Swaminathan Krishnaswamy, Musthafa Mohamed Essa, et. al.. (2019). Therapeutic efficacy of nanoparticles and routes of administration. Biomater Res. 23;
- Christine E. Krewson, Michele L. Klarman, W. Mark Saltzman. (1995). Distribution of nerve growth factor following direct delivery to brain interstitium. Brain Research. 680, 196-206;
- Zian Wang, Guojun Xiong, Wai Chun Tsang, Andreas G. Schätzlein, Ijeoma F. Uchegbu. (2019). Nose-to-Brain Delivery. J Pharmacol Exp Ther. 370, 593-601;
- L. V. Rubis. (2018). CHARACTERISTICS OF THE CAUSATIVE AGENTS OF ACUTE RESPIRATORY VIRAL INFECTIONS AND THE IMPORTANCE OF DISINFECTION MEASURES IN PREVENTING THEIR SPREAD. Det. infekc.. 17, 34-40.
Наночастицы в мозге превратили тепло в свет и заставили мышей бояться
Исследователи, работающие в области оптогенетики, научились неинвазивно
активировать нейроны, способные возбуждаться под действием света. Вместо
оптоволокна, которое нужно вводить в мозг через отверстие в черепе, модельным
животным вкалывали наночастицы, способные превращать инфракрасное излучение в
излучение синего спектра, возбуждающее модифицированные нейроны. Управлять
активностью нейронов и стимулировать глубокие отделы мозга, таким образом, теперь можно прямо через ткани при помощи инфракрасного
лазера. Исследование опубликовано в Science.
Оптогенетика позволяет направленно управлять активностью
отдельных групп нейронов, экспрессирующих каналородопсин (ChR). Этот белок начинает пропускать ток
под действием синего света и вызывает деполяризацию мембраны нейрона. Так как
биологические ткани не пропускают свет видимого спектра, для управления нейронами
в мозг модельным животным (чаще всего мышам) приходится вводить оптоволокно.
Ученые из японского института исследования мозга RIKEN в
сотрудничестве с коллегами из Национальных университетов Токио и Сингапура
предложили альтернативный способ активации нейронов при помощи ап-конверсионных
наночастиц.
Эти наночастицы, содержащие ионы металлов из ряда лантаноидов,
конвертируют несколько фотонов с большой длиной волны в один фотон с более
высокой энергией, и соответственно, меньшей длиной волны.
Такие наночастицы
дают возможность использовать для
стимуляции глубоких отделов мозга инфракрасное излучение, хорошо проникающее в
ткани, а «на месте» превращающееся в видимый свет.
Схема активации канала при помощи ап-конверсионных наночастиц
Neus Feliu et al / Science 2018
Исследователи приготовили наночастицы с металлическим ядром
и покрыли их оксидом кремния, чтобы избежать токсичного эффекта, обусловленного
контактом ядра с тканями. После подтверждения безопасности присутствия
наночастиц в нервной ткани, мышам ввели генетическую конструкцию, кодирующую
каналородопсин, в область среднего мозга, отвечающую за синтез дофамина. Затем
в ту же область мозга сделали инъекцию наночастиц, после чего на эту зону
воздействовали излучением ближнего инфракрасного диапазона (980 нанометров)
транскраниально (сквозь череп). Контрольный оптоволоконный датчик зафиксировал
в мозге излучение нужной длины волны (соответствующей синему свету), а на
физиологическом уровне исследователи наблюдали активацию дофаминовых нейронов и
синтез дофамина в этой зоне.
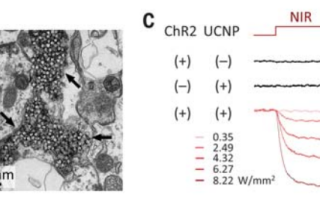
«Беспроводная» оптогенетика подразумевает модификацию нейронов геном каналородопсина (ChR), инъекцию наночастиц (UCNP) и затем облучение ближним инфракрасным светом (NIR)
Shuo Chen et al / Science 2018
Наночастицы в культуре нейронов (слева) и вызванный облучением потенциал нейронов, содержащих каналородопсин, при взаимодействии с наночастицами
Shuo Chen et al / Science 2018
В следующих экспериментах при помощи наночастиц исследователи
успешно синхронизировали активность нейронов в гиппокампе спящих животных и «заставили»
их генерировать тета-ритм. Ученым также удалось воспроизвести более впечатляющий
эксперимент на бодрствующих мышах, ранее реализованный при помощи «классической»
оптогенетики. Помещая мышей в клетку, в которой их било током, ученые записали «схему»
активации нейронов гиппокампа, вовлеченных в формирование плохого воспоминания
и связанной с ним реакции — страха. При помощи выборочной активации этих
нейронов инфракрасным излучением ученые вызывали у мышей страх даже в
безопасном месте.
Конверсионные наночастицы ранее использовались для активации
нейронов в клеточной культуре и на рыбках Danio rerio. Однако на млекопитающих успешность неинвазивного
подхода и возможность с его помощью даже управлять поведением животных удалось
показать впервые.
Теоретически неинвазивная активация отделов мозга может быть
использована и на людях — к примеру, глубокая
стимуляция при помощи электродов в настоящее время рассматривается как
перспективное средство терапии болезни Паркинсона и большого депрессивного
расстройства.
Главным препятствием для введения этого метода в клинику является
необходимость генетической модификации нейронов, так что пока оптогенетика во
всех ее формах является уделом лабораторных животных.
В прошлом году мы рассказывали, что российские биологи
предложили активировать нейроны инфракрасным излучением с использованием вместо
каналородопсина термочувствительного белка змей.
Дарья Спасская
Создан новый тип липидных наночастиц для доставки веществ в мозг
Доставка в мозг препаратов, предназначенных для лечения нейродегенеративных болезней, злокачественных опухолей, инфекций и инсультов, сильно осложняется тем обстоятельством, что многие из них при внутривенном введении не попадают в мозг из-за гематоэнцефалического барьера (ГЭБ).
В статье, вышедшей в ScienceAdvances, предлагается новая система доставки веществ в мозг с помощью липидных наночастиц, в которые были вставлены синтетические липиды, созданные на основе нейромедиатора триптамина. Авторы работы назвали их NT-липидоидами (NT — от англ. Neurotransmitter).
Благодаря NT-липидоидам наночастицы, сами по себе не способные к пересечению ГЭБ, могут эффективно проникать через него и доставлять свой груз в мозг.
Исследователи продемонстрировали возможности нового инструмента, доставив различные вещества в мозг мыши: гидрофобный флуоресцентный краситель, малые молекулы препарата амфотерицина B, биомакромолекулы — антисмысловые олигонуклеотиды и молекулы рекомбиназы Cre, сшитой с зелёным флуоресцентным белком (GFP).
Амфотерицин B является мощным противогрибковым средством, и авторы работы ранее уже детально изучили его фармакокинетику в составе липидных наночастиц. Однако в предыдущем исследовании амфотерицин B не попадал в мозг из-за ГЭБ.
Антисмысловой олигонуклеотид, успешно доставленный в мозг, был предназначен для нокдауна гена, кодирующего тау-белок, который задействован в развитии болезни Альцгеймера.
Так как после внутривенного введения олигонуклеотида уровень мРНК тау-белка в нейронах головного мозга действительно снизился, новая платформа доставки не только обеспечила беспрепятственный проход молекул в мозг, но и позволила им проникнуть в клетки, сохранив свою функциональность.
Рекомбиназа Cre является одним из инструментов редактирования генов и вырезает последовательность, расположенную между двумя сайтами lox.
Авторы работы продемонстрировали эффективность доставки функциональной рекомбиназы Cre в мозг с помощью новой платформы на примере мышей линии Ai14, которые несут искусственную вставку в геноме, окруженную сайтами lox.
Как и в случае с олигонуклеотидом, липидные частицы с NT-липидоидами не только успешно доставляют фермент в мозг, но и обеспечивают его проникновение в клетки с сохранением функциональности.
Авторы работы показали, что липидные наночастицы с NT-липидоидами являются эффективными инструментами для доставки в головной мозг не только низкомолекулярных соединений, для которых ГЭБ непроницаем, но и инструментов для нокдауна генов и геномного редактирования посредством рекомбинации. Исследователи утверждают, что новая платформа может найти применение как в лечении разнообразных заболеваний нервной системы, так и в исследовательских задачах.
Схема доставки веществ в мозг с помощью NT-липидоидов (1), формулы и схема синтеза NT-липидоидов (2) и результаты доставки метки в мозг с помощью различных конструкций NT-липидоидов (3).
Credit: Feihe Ma et al. По Creative Commons Attribution-NonCommercial license
Сибирские ученые узнали, как наночастицы вирусов попадают в мозг из воздуха
© 360tv.ru
24 Дек 2019, 08:06
Ученые Института цитологии и генетики Сибирского отделения РАН и Биологического института Томского госуниверситета (ТГУ) установили путь, по которому наночастицы вирусов, а также органических и неорганических веществ из окружающей среды проникают в головной мозг. Об это рассказали в пресс-службе ТГУ 24 декабря.
«В окружающей среде присутствует большое количество наночастиц самых разных химических элементов и их соединений, от безобидных до токсичных, например, оксидов тяжелых металлов, — объяснил директор Центра генетических ресурсов лабораторных животных ИЦИГ, профессор ТГУ Михаил Мошкин.
— Учеными накоплен ряд данных, которые свидетельствуют о неблагоприятном влиянии наночастиц, например, если люди живут ближе 50 метров от крупных магистралей, за счет накопления наноразмерных частиц в мозге у них раньше развиваются нейродегенеративные заболевания (болезни Альцгеймера, Паркинсона и другие)».
Наночастицы не могут проникнуть в мозг через легкие и кровеносные сосуды. Исследования на грызунах помогли вычислить траекторию их движения. Оказалось, что при введении раствора с наночастицами в нос они появляются в обонятельной луковице мозга уже через три часа. Через 12 часов концентрация достигает максимума, в других структурах мозга — через 3−4 дня.
«Движение четко соответствует траектории нервных связей обонятельной системы», — отметили исследователи, уточнив, что не все наночастицы преодолевают барьеры организма.
«Выделено две группы факторов: первая — вещества, влияющие на состояние мукозального слоя, покрывающего окончания обонятельных нейронов, вторая — вещества, влияющие на мембранный потенциал обонятельных рецепторов. В итоге удалось найти комбинации химических соединений, которые либо полностью блокируют, либо существенно усиливают транспорт наночастиц из носовой полости в мозг», — рассказали в ТГУ.
Кроме того, ученые выяснили, что при введении некоторых наночастиц в нос грызунов температура их тела быстро снижалась на несколько градусов, при этом происходил отток цереброспинальной жидкости.
«Оказалось, что в носу происходит целый каскад событий.
Выявленные эффекты значимы для разработки новых способов терморегуляции и решения такой серьёзной проблемы, как лечение отёка головного мозга, — рассказал Мошкин.
— Наночастицы сейчас вводят в состав разных препаратов для повышения их КПД. Полученные данные помогают понять, как нарастает концентрация этих частиц и как их можно вводить в организм пациента».
Исследования нужны для выяснения проникающей способности вирусов, в том числе гриппа. Информация позволит разработать дополнительные меры профилактики.
Нанотехнологии в нейропсихиатрии
Нанотехнология включает в себя манипуляции с частицами на атомном и молекулярном уровне, по крайней мере, с одним измерением в пределах 100 нм.
Такие свойства, как физическое, химическое, биологическое, распределение по размерам, морфология и характеристики, являются уникальными, а по сравнению с объемными материалами их эффективность в определении локализации клеток является достаточно успешной.
В прошлом наночастицы благородных металлов (NPs), магнитные NPs и квантовые точки (QDs) использовались для различных исследовательских и терапевтических целей, включая доставку лекарств, анализа ионов металлов, белков и биомаркеров нуклеиновых кислот.
Некоторые из NP были использованы в качестве агентов визуализации и показали определенный потенциал при разработке новых препаратов.
Термин «тераностика» обычно используется для обозначения более специфической и индивидуальной терапии различных заболеваний. Синтез наноразмерных носителей, состоящих из липидов, полимеров, углерода или металлов, преодолел ограничения, с которыми сталкиваются при традиционных способах доставки лекарств.
Термин «нейродегенеративные расстройства» (ND) определяет состояния, которые являются спорадическими и семейными и характеризуются также постепенным снижением когнитивных функций ( мышления, памяти, внимания ) и часто нарушением целенаправленной деятельности.
У ND есть некоторые сходства на субклеточном и молекулярном уровне, такие как синаптические аномалии, потеря нейронов и появление отложений в разных структурах головного мозга, которые вызваны агрегацией неправильно свернутых белков.
Тем не менее, на субклеточном уровне существуют важные отличия от других заболеваний, поражающих мозг, таких как рак или инсульт.
Тераностическая наномедицина является новой перспективной областью в терапевтической парадигме.
Магнитно-резонансная томография (МРТ), позитронно-эмиссионная томография и однофотонная эмиссионная компьютерная томография сегодня доступны для отслеживания тераностики и систем клинической ядерной визуализации после успешной доставки.
Тераностики широко использовались для визуализации и терапии, а также для разработки целевых систем доставки лекарств от рака, диабета, нарушений ЦНС, иммунных нарушений и генетических нарушений.
Различные препараты с различными механизмами, эффектами и мишенями были разработаны для лечения расстройств ЦНС; тем не менее, показатель успеха оказался не таким уж значительным.
Недостаточная эффективность здесь может объясняться наличием гемато — энцефалического барьера (ВВВ), неселективным распределением лекарств в мозге, опсонизацией белков плазмы в кровообращении и периферическими побочными эффектами при высвобождении лекарств.
NPs получили признание благодаря легкости их проникновения в ЦНС; например, различные полимерные, липидные и неорганические NPs помогают в доставке лекарств и высвобождении лекарств при разных состояний ЦНС.
Из-за отсутствия фенестрированной и внутриклеточной щели BBB не позволяет проникать растворенным веществам с периферии в мозг. Эндотелиальные клетки в мозге и кровеносном сосуде имеют компактные периферические соединения , поэтому параклеточные пути между клетками устранены.
Выделяют следующие механизмы транспортировки молекул через гемато — энцефалический барьер :
- Диффузия: некоторые маленькие липофильные и низкомолекулярные молекулы (
Технологический прорыв российских учёных в лечении опухоли мозга
ТЕХНОЛОГИИ БУДУЩЕГО — СЕГОДНЯ
РОССИЙСКИЕ ОНКОЛОГИ ПЕРВЫМИ В МИРЕ ВЫПОЛНИЛИ ИЗОЛИРОВАННУЮ ПЕРФУЗИЮ ГОЛОВНОГО МОЗГА ПАЦИЕНТКЕ С ДИАГНОЗОМ «ГЛИОБЛАСТОМА»
23 августа 2021 года на базе МНИОИ им П.А.
Герцена (филиал ФГБУ «НМИЦ радиологии» Минздрава России) при участии мультидисциплинарной команды специалистов ФГБУ «НМИЦ радиологии» Минздрава России (Москва-Обнинск), Костромского онкологического диспансера (Кострома), НИИ Краевой клинической больницы №1 им.
профессора Очаповского (Краснодар), Санкт-Петербургского научно-исследовательского института скорой помощи им. И.И. Джанелидзе (Санкт-Петербург) состоялась первая в мире процедура изолированной перфузии головного мозга пациентке с диагнозом «глиобластома».
Доклинические исследования этого перспективного метода лечения пациентов с онкологическими заболеваниями органов головы и шеи начались еще в феврале 2021 года на базе НИИ медицинской приматологии в г. Сочи и завершились в августе 2021 года.
Всего учеными было проведено три этапа доклинических исследований, участие в которых приняло 18 моделей павиан-гамадрил.
Экспериментальная методика на нечеловекообразных обезьянах продемонстрировала хорошую переносимость метода с отсутствием признаков системной токсической реакции, что было подтверждено данными клинико-лабораторных, физиологических и патологоанатомических исследований.
О МЕТОДЕ: За счет особого строения и структуры тканей головного мозга опухоли данной локализации, к которым в том числе относят глиобластомы, крайне сложно поддаются лечению.
Суть инновационного метода заключается в том, что во время медицинской манипуляции головной мозг кровоснабжается отдельно от тела с помощью аппарата искусственного кровообращения.
На этом этапе к органу доставляются концентрированные дозы химиопрепарата, губительные для опухоли, но безопасные для самого органа. После того, как токсичность снижается, орган вновь подключается к общей системе кровообращения.
В клиническое исследование включена молодая пациентка 45 лет с диагнозом глиобластома правой теменной и лобной долей. Все стандартные методы лечения этого грозного заболевания у нее были исчерпаны, наблюдался продолжительный рост опухоли. После проведенного консилиума, 23 августа 2021г. пациентке была выполнена процедура изолированной химиоперфузии головы и шеи.
Операция длилась 5 часов 30 минут и завершилась успешно, был выполнен весь запланированный объем оперативного вмешательств. В мультидиципилинарной бригаде высокопрофессиональных специалистов под руководством академика РАН А.Д.
Каприна в составе 20 человек участвовали выдающиеся нейрохирурги, анестезиологи, реаниматологи, кардиохирурги, перфузиологи сразу пяти научных медицинских институтов.
В настоящее время пациентка находится под самым пристальным контролем специалистов МНИОИ им П.А. Герцена.
По итогам пяти дней врачи отмечают, что тяжесть состояния больной соответствует срокам и объёму выполненной операции, а все когнитивные функции головного мозга сохранены в полном объеме.
Пациентке проводится плановая инфузионная, антибактериальная, антикоагулянтная, симптоматическая терапия.
Клиническое исследование данной методики будет продолжено, однако уже сегодня понятно, что благодаря ему у многих пациентов с подобными диагнозами появилась надежда на жизнь.
Пресс-служба ФГБУ «НМИЦ радиологии» Минздрава России