Распространенность диабета, связанного с COVID-19, является результатом действия не одного фактора, а сочетания склонности к развитию заболевания и специфических для COVID-19 механизмов, влияющих на метаболизм. Пока не ясно, существует ли особая форма «постковидного» диабета (связанная, как предполагают, с длительным повреждением β-клеток).
В своей статье автор основывается на личном опыте лечения пациентов с COVID-19 в пресвитерианской больнице при Колумбийском университете (Нью-Йорк). Автор работал там с марта 2020 года, когда в Нью-Йорке разразилась пандемия.
Первая волна достигла пика в середине апреля, когда, согласно внутрибольничной переписи, с диагнозом COVID-19 находилось 772 пациента, из которых около 280 человек нуждались в инвазивной искусственной вентиляции легких или экстракорпоральной мембранной оксигенации.
С первых дней пандемии пациенты с диабетом составляли значительную долю среди госпитализированных, а уже среди них подавляющую часть составляли лица в кетоацидотическом состоянии.
Итоги и эмпирические наблюдения совместной работы автора с его коллегами на медицинском факультете университетской клиники Колумбийского университета и Пресвитерианской больницы Нью-Йорка представлены в другой работе [1].
Недавние мета-анализы подтвердили высказывавшиеся ранее предположения о том, что сахарный диабет является фактором риска для развития коронавирусной инфекции [2], госпитализации в отделение интенсивной терапии и случаев, когда оказание неотложной помощи является жизненно необходимым [3, 4].
Также диабет является фактором риска для таких жизнеугрожающих состояний, когда требуется проведение интубации трахеи и искусственной вентиляции легких [5], заместительной почечной терапии [6]; повреждения миокарда [7], тромбоэмболических осложнений [8] и летального исхода [9].
Личный опыт работы автора служит наглядной демонстрацией такой статистики: у большинства пациентов, поступавших в состоянии гипергликемии и кетоацидоза, выявлялся плохо контролируемый сахарный диабет (гликозилированный гемоглобин HbA1c ≥ 10 %/ 13,3 ммоль).
Хотя преобладающим был диабет второго типа, автор сталкивался и со случаями диабета первого типа, однако все они характеризовались контролируемым течением. По показателю гликозилированного гемоглобина удавалось диагностировать впервые выявленный сахарный диабет, что было очень распространенной ситуацией.
Исключить факт существования сахарного диабета ранее, особенно в условиях госпитализации в связи с тяжелой формой COVID-19, оказалось сложной задачей.
У пациентов мог быть близкий к нормальному уровень HbA1c в результате изменения образа жизни, или же HbA1c находился на грани нормы и патологии, а пороговое значение оказалось достигнутым вследствие тяжелого течения самой коронавирусной инфекции.
Тем не менее, у пациентов без четких признаков диабета может выявиться гипергликемия на фоне стресса, и в такой ситуации длительная противодиабетическая терапия не является целесообразной. Только долгосрочное наблюдение позволяет достоверно обнаружить, способствует ли COVID-19 дебюту диабета по сравнению с другими провоцирующими факторами. К примеру, часто внебольничная пневмония сопровождается гипергликемией у пациентов без диабета, однако в случае пожилых людей это может быть его предвестником. Таким образом, гипергликемия сама по себе не уникальна для COVID-19 (рис. 1).
Был поднят вопрос о том, может ли SARS-CoV-2 (вирус, являющийся причиной COVID-19) среди прочего вызывать диабет. Но выявление четкой причинно-следственной связи, выходящей за рамки случайного совпадения, остается сложной задачей.
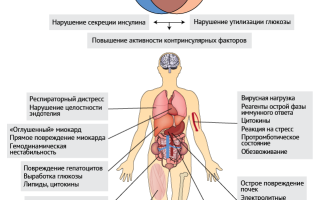
По-видимому, в основе патогенеза гипергликемии при COVID-19 лежит несколько причин; в первую очередь, нарушение утилизации глюкозы, а также снижение секреции инсулина (рис. 1).
Любое воспалительное состояние может вызвать инсулинорезистентность и усилить выработку глюкозы в печени за счет повышения уровня контринсулярных гормонов, выброса цитокинов и липидов и прямого повреждения гепатоцитов.
Кроме того, воспаление может нарушать поглощение глюкозы периферическими тканями из-за гиподинамии, истощения мышечной ткани, цитокинов и нарушений водно-электролитного баланса, что изменяет проницаемость мембран. Ожирение — еще один важный фактор риска для упомянутых выше сопутствующих заболеваний [10], а местное воспаление жировой ткани может служить потенциальным объединяющим фактором «триады» (нарушение метаболизма глюкозы, воспаление и нарушение иммунного ответа) (рис. 1).
Рисунок 1 | Механизмы COVID-ассоциированной гипергликемии и кетоацидоза Существование гипергликемии и кетоацидоза у пациентов с COVID-19 подняло вопрос, не лежит ли в основе этого сахарный диабет вне зависимости от того, присутствовал ли он у человека ранее. Кетоацидоз может возникнуть независимо от гипергликемии даже у пациентов, которые не лечились ранее ингибиторами натрий-глюкозного котранспортера Sglt2. Механизмы данных метаболических нарушений включают: нарушение утилизации глюкозы, снижение секреции инсулина или усиление контринсулярных реакций. На рисунке рядом с каждым органом-мишенью показаны патофизиологические особенности при сочетании сахарного диабета, любого острого интеркуррентного заболевания и факторов, специфичных для COVID-19. В зависимости от клинического течения эти аномалии могут развиваться не все сразу, а постепенно.
Высокая распространенность кетоацидоза среди пациентов с COVID-19 и диабетом [11] необычна и поднимает вопрос о способности вируса воздействовать на β-клетки поджелудочной железы. Необходимо различать пациентов с гипергликемическим и эугликемическим кетоацидозом.
Также необходимо помнить, что почти не существует прецедентов вирусных инфекций, которые приводили бы к значительному клиническому повреждению β-клеток при отсутствии предрасполагающего аутоиммуннитета, и что причиной кетоацидоза является не только низкое содержание инсулина, но и изменение соотношения глюкагон/инсулин.
Таким образом, предположение о том, что COVID-19 приводит к кетоацидозу, который развивается вследствие прямого повреждения β-клеток, требует тщательного изучения. Автор полагает, что причина, вероятнее всего, окажется многокомпонентной, и внепанкреатические факторы, вероятно, играют большую роль, чем внутрипанкреатические.
Среди последних — нарушение секреции инсулина у пациентов с неконтролируемой гипергликемией обусловлено «оглушением» β-клеток [12]. Цитокиновый шторм, связанный с COVID-19, склонность к тромбозам (потенциально затрагивает микрососудистое русло и непосредственно β-клетки) также могут стать причиной повреждения β-клеток.
Гипотеза о том, что COVID-19 вскрывает тип диабета, характеризующегося склонностью к кетозу, привлекательна, однако объясняет вышеописанное патологическое состояние лишь частично, потому что неизвестно, что именно способствует развитию кетоза у этих пациентов.
Однако многие пациенты с COVID-19 поступают в катаболическом, кетоацидотическом состоянии, усугубляемом сниженной способностью компенсации метаболического ацидоза посредством почечных и легочных механизмов вследствие:
- сопутствующей острой почечной недостаточности со сниженной реабсорбцией анионов HCO3–;
- нарушения легочного газообмена, который должен предотвращать компенсаторный респираторный алкалоз.
Кроме того, лихорадка и снижение поступления жидкости в организм (нарушение пищевого режима) истощает пациента, что усугубляет электролитные нарушения.
Активация таких механизмов (патологически действующих в данной ситуации), как контринсулярная система, по всей видимости, приводит к дальнейшему подавлению функции β-клеток.
Эти факторы могут служить объяснением эугликемического кетоацидоза, а также напоминанием о том, что экстрапанкреатические факторы не менее важны, чем потенциальное прямое воздействие на β-клетки, по степени воздействия на метаболизм и запуск гипергликемического кетоацидоза.
Может ли SARS-CoV-2 непосредственно повредить β-клетки? Точного ответа нет.
Результаты исследований РНК, доступные в начале пандемии, свидетельствовали о том, что рецептор АПФ2, используемый вирусом SARS-CoV-2 для проникновения в клетку, отсутствует в β-клетках, тогда как рецептор TMPRSS (мембранно-связанная сериновая протеаза 2) и недавно открытый рецептор NRP1 (нейропилин 1) присутствуют, хотя и в незначительном количестве [13].
Некоторые результаты иммуногистохимических исследований панкреатических островков согласуются с этими выводами [14, 15], тогда как согласно иным данным, рецепторы вируса SARS-CoV-2 находятся и в β-клетках [16].
Может ли экспрессия этих рецепторов запускаться в β-клетках вследствие коронавирусной инфекции? Такая индукция возможна, однако продемонстрировать ее в эксперименте очень трудно.
По опыту автора и его коллег, отсутствует явная связь между диабетическим кетоацидозом и показателями воспаления, такими как количество лейкоцитов и тромбоцитов, С-реактивный белок, D-димер и ферритин.
Однако для того, чтобы вирус сам по себе приводил к значительному снижению функционала β-клеток, и таким образом нарушилась секреция инсулина, количество проникших вирусных частиц в клетку должно быть значительным.
Кроме того, если бы вирус приводил к необратимому нарушению функции β-клеток, развивающийся диабетический кетоацидоз после коронавирусной инфекции требовал бы инсулинотерапии, чего не наблюдается в практике. Действительно, в большинстве случаев кетоацидоз в острой фазе заболевания бывает легкой или средней степени тяжести. Трудности, возникающие при лечении кетоацидоза при COVID-19 экстрапанкреатического характера: при инфузионной терапии часто приходится соблюдать очень тонкий баланс между поддержанием адекватной перфузии органов и предотвращением накопления жидкости в легких вследствие респираторного дистресс-синдрома, «оглушенного» миокарда или развившегося повреждения миокарда и протромботического состояния. Повреждение почечных канальцев также приводит к длительным и необычным нарушениям электролитного баланса, которые купируются с трудом. Помимо этого, в связи с широко распространенным использованием глюкокортикостероидов при лечении COVID-19 восстановление функции β-клеток может замедляться.
По мнению автора, вопрос о том, поражает ли вирус β-клетки, слишком ограничен в плане клинического приложения. Независимо от уровней экспрессии рецепторов к SARS-CoV-2, существует крайне мало свидетельств того, что вирусные инфекции напрямую вызывают необратимое повреждение β-клеток [17].
Стресс-индуцированная гипергликемия, вызванная инфекцией, обычно носит временный характер. Предполагается, что только у пациентов, предрасположенных к развитию диабета первого типа, вирусная инфекция с интеркуррентным течением способна окончательно нарушить функцию β-клеток.
Соответственно, если COVID-19 действительно являлся бы причиной стойкого инсулинозависимого диабета, вирус SARS-CoV-2 был бы уникальным. Сведения о SARS1 в этом отношении неубедительны [18].
Однако, если бы COVID-19 вызвал потерю β-клеток у пациентов с предрасполагающим к этому аутоиммунным фоном, в связи с пандемией наблюдалась бы повышенная заболеваемость сахарным диабетом первого типа. Ограниченный объем сведений по этому вопросу не подтверждает такой сценарий развития [19].
Однако, возможно, число случаев диабета первого типа учтено не полностью, потому что пациенты избегают лечения в крупных медицинских центрах (в том числе, в университетских клиниках), и с большей вероятностью обратятся за медицинской помощью в амбулаторное звено.
Согласно недавним сведениям о генетической аутоиммунной предрасположенности к развитию дыхательной недостаточности у пациентов с COVID-19 [20], предложен план исследований, нацеленных на выявление аутоиммунных звеньев патогенеза кетоацидоза при сахарном диабете первого типа, связанного с COVID-19. Однако остается неясным, будет ли достаточно пациентов для проведения такого исследования.
Существует несколько причин, по которым люди с диабетом более восприимчивы к COVID-19. Помимо этого, поскольку сахарный диабет является мультифакторным заболеванием, механизмы, действующие у отдельных пациентов, также могут быть неоднородными.
Нельзя сбрасывать со счетов вероятность того, что SARS-CoV-2 может вызвать диабет, но и не нужно приписывать данное патологическое состояние безосновательно, особенно при отсутствии непосредственно указывающих на него фактов. Необходимо с осторожностью истолковывать результаты исследований, в которых проводилась оценка восприимчивости β-клеток к инфекции SARS-CoV-2 in vitrо.
Возможность стимуляции развития инфекции в условиях пробирки не служит доказательством того, что инфекция может развиться in vivo.
Хороший контроль гликемии — лучший способ уберечь людей с диабетом от палаты интенсивной терапии при COVID-19.
Необходимо продолжать отслеживать возможность того, что развитие вторичного сахарного диабета является отдельным клиническим проявлением в рамках «длительно протекающего COVID-19», а люди с сахарным диабетом должны быть вакцинированы одними из первых.
Рациональная инсулинотерапия остается единственным эффективным и безопасным способом лечения диабетического кетоацидоза при COVID-19, а у пациентов должен осуществляться постоянный дистанционный контроль гликемии как в палатах интенсивной терапии, так и в постреанимационных палатах для контроля воздействия вируса на пациентов, являющихся носителями.
Заболевание глаз у диабетиков связали с повышенным риском тяжелого течения COVID-19
Человеческий глаз / pixabay.com
Это заболевание глаз довольно часто встречается у диабетиков: в 2014 году его распространенность составляла 54,6% среди пациентов с диабетом 1 типа и 30% — 2 типа. Исследователи Королевского колледжа Лондона (King’s College London) первыми установили взаимосвязь между тяжелым течением COVID-19 и диабетической ретинопатией.
Ученые проанализировали данные 187 диабетиков с COVID-19, госпитализированных в больницы Фонда здравоохранения Гая и Св. Томаса (Guy’s and St Thomas’ NHS Foundation Trust) с марта по апрель.
В этой выборке 26% больных понадобилась искусственная вентиляция легких (ИВЛ), из них 45% страдали диабетической ретинопатией. Ученые сделали вывод, что это заболевание глаз может потенциально в пять раз увеличить риск тяжелого течения коронавирусной инфекции с необходимостью ИВЛ.
При этом природа связи между диабетической ретинопатией и повышенным риском смертности не установлена.
Ученые предположили, что тяжелое течение COVID-19 провоцирует повреждение кровеносных сосудов при диабетической ретинопатии.
Возможно, это одна из причин, почему пациенты с сахарным диабетом подвержены высокому риску сосудистых осложнений, затрагивающих как мелкие, так и большие сосуды при COVID-19. Это может привести к тяжелой дыхательной недостаточности.
Однако для того, чтобы определить причинно-следственную связь между диабетической ретинопатией, потребуются дополнительные исследования, отметили специалисты.
Авторы исследования рекомендовали врачам уделять повышенное внимание пациентам с COVID-19, у которых диагностировано это заболевание глаз или другие сосудистые осложнения диабета. Возможно также, что таким людям необходимо предоставить приоритетное право на вакцинацию, которая стартует в 2021 году.
Ранее Национальная система здравоохранения (NHS) заявила о том, что общий уровень смертности среди диабетиков в Великобритании удвоился на ранних стадиях пандемии.
Согласно отчету NHS, при COVID-19 риск смерти у людей с сахарным диабетом 1 типа в 3,5 раза выше по сравнению с риском недиабетиков. Вероятность смерти пациентов с диабетом 2 типа при COVID-19 в два раза выше, чем у тех, кто не страдает этим заболеванием.
Возраст также остается важным фактором, влияющим на риск смерти от COVID-19 людей с диабетом любого типа.
«Высокий риск осложнений»: чем COVID-19 грозит диабетикам — Газета.Ru
Болезнь глаз у диабетиков в пять раз повышает риск осложнений при коронавирусе, предупреждают британские специалисты. Вероятно, повреждение сосудов глаз свидетельствует о поражении сосудов всего организма, что и приводит к более тяжелому течению COVID-19. Однако на смертности это не сказывается.
При диабетической ретинопатии риск тяжелого течения COVID-19 возрастает в пять раз, выяснили исследователи из Королевского колледжа Лондона. Работа была опубликована в журнале Diabetes Research and Clinical Practice.
Диабетическая ретинопатия — одно из наиболее тяжелых осложнений сахарного диабета.
При ней из-за расстройства микроциркуляции поражаются сосуды сетчатки, что в перспективе приводит к потере зрения. Ретинопатию можно сдержать с помощью коррекции рациона, инсулинотерапии и оперативных вмешательств, а также ряда препаратов.
Авторы работы обратили внимание на 187 человек с диабетом (179 из них с диабетом 2 типа), госпитализированных с 12 марта по 7 апреля 2020 года. У 67 (36%) пациентов имелась диабетическая ретинопатия.
Из 187 пациентов 26% были интубированы, и 45% из интубированных имели ретинопатию. Исследователи связывают ретинопатию с пятикратным ростом вероятности интубации.
В когорте умерло 32% пациентов, однако никакой связи между ретинопатией и смертностью не наблюдалось.
«Это первый случай, когда ретинопатия была связана с тяжелой формой COVID-19 у людей, страдающих диабетом.
Ретинопатия — маркер повреждения кровеносных сосудов, и наши результаты позволяют предположить, что существовавшее ранее повреждение кровеносных сосудов может привести к более тяжелой инфекции COVID-19, требующей интенсивной терапии», — говорит доктор Антонелла Корцилло, одна из авторов исследования.
«Появляется все больше доказательств того, что у пациентов, госпитализированных с тяжелой формой COVID-19, имеются значительные повреждения кровеносных сосудов в легких и других органах, — добавляет ведущий автор исследования доктор Янака Каралледде.
— Люди, страдающие диабетом, подвержены высокому риску осложнений, поражающих большие и малые кровеносные сосуды.
Мы выдвигаем гипотезу о том, что наличие сосудистых заболеваний, связанных с диабетом, таких как ретинопатия, может привести к большей уязвимости и восприимчивости к респираторной недостаточности при тяжелой форме COVID-19.
Поэтому поиск в анамнезе ретинопатии или других сосудистых осложнений диабета способен помочь медицинским работникам выявить пациентов с высоким риском тяжелой формы COVID-19».
«Мы надеемся, что эти исследования приведут к повышению осведомленности тех, кто в наибольшей степени подвержен риску серьезных осложнений, связанных с COVID-19, — говорит офтальмолог Луиза Гоу.
— По мере планирования вакцинации необходимо уделять первоочередное внимание людям, страдающим диабетической ретинопатией.
Также жизненно важно, чтобы информация о COVID-19 была доступна в формате, подходящем для людей с потерей зрения, чтобы они знали, как защитить себя».
Чтобы изучить возможные механизмы, объясняющие связь между сосудистыми заболеваниями при диабете и тяжелой формой COVID-19, нужны более подробные исследования, подчеркивают авторы. Также предстоит более подробно исследовать причинно-следственную связь между COVID-19 и диабетической ретинопатией и проверить результаты на большей выборке.
Хронические заболевания — один из наиболее серьезных факторов риска при COVID-19. Как ранее установили ученые из Государственного медицинского колледжа Пенсильвании, по сравнению с другими больными,
у пациентов с диабетом и раком вероятность смерти в 1,5 раза выше, у пациентов с сердечно-сосудистыми заболеваниями, гипертонией, застойной сердечной недостаточностью и болезнями сосудов мозга в два раза выше, а у пациентов с хроническими заболеваниями почек в три раза выше.
Астма и ВИЧ/СПИД при этом не давали значимого вклада в смертность. ХОБЛ повышала риски менее чем в 1,5 раза, хронические болезни печени — в 1,7 раза.
Исследователи надеются, что их результаты помогут другим специалистам в области здравоохранения улучшить уход за пациентами и разработать меры, которые будут направлены на работу с группами повышенного риска.
COVID-19 и сахарный диабет
За время пандемии COVID-19 многие крупные исследования подтвердили прямую взаимосвязь между тяжестью течения инфекционного заболевания и наличием в анамнезе сахарного диабета.
Мета-анализ 8 исследований с участием почти 50 тысяч пациентов с COVID-19 показал, что сахарный диабет (СД) занимает второе место среди наиболее распространенных сопутствующих заболеваний после артериальной гипертензии [1].
По мнению специалистов, высокий риск развития инфекции у пациентов с СД объясняется нарушениями иммунитета в связи с гипергликемией и ее острыми и хроническими последствиями.
Кроме того, повышенный уровень цитокинов увеличивает риск развития тяжелой формы инфекции.
[2]Исследования китайских ученых выявили, что сахарный диабет чаще встречается среди пациентов именно с тяжелым течением COVID-19, чем среди пациентов с нетяжелой формой заболевания: 16,2% против 5,7%, и прогноз COVID-19 у пациентов СД был хуже [3].
Согласно данным ряда работ, диабет выступает и как фактор риска смертности у пациентов с COVID-19. Большое национальное выборочное исследование показало, что смертность пациентов с диабетом была значительно выше, чем у пациентов без него: 10% против 2,5% [3].
Показатель летальности больных без коморбидных состояний в Китае составлял 0,9%, в то время как у пациентов с СД он достиг 7,3%.
[4] Исследование клинических характеристик случаев смерти с COVID-19 выявило, что одной из причин смертности пациентов является диабетический кетоацидоз [5].
Потенциальные механизмы развития тяжелых форм СOVID-19 при СД
У пациентов с сахарным диабетом в сыворотке крови выявляется высокий уровень IL-6, TNF-a и других воспалительных цитокинов [6], и эксперименты на животных моделях заставили предположить, что СД приводит к усиленной выработке TLR4-индуцированного IL-6 [7]. Коронавирус, включая SARS, вероятно активирует TLR3 и TLR4, что приводит к неконтролируемому иммунному ответу и IL-6-доминантному цитокиновому шторму. Именно он, по всей видимости, и является одной из ведущих причин смерти от коронавирусной пневмонии. [8]
Чрезмерная активация TLR4 сигнального пути у пациентов с СД может способствовать прогрессированию заболевания до тяжелых форм и даже летального исхода.
Взаимное влияние COVID-19 на сахарный диабет: порочный круг
Если СД ухудшает прогноз и повышает степень тяжести инфекционного процесса, то и вирус SARS-CoV-2 повышает уровень гликемии и ухудшает течение СД.
В исследовании с участием пациентов с SARS было обнаружено, что даже при легкой форме COVID-19 у больных был высокий уровень гликемии натощак.
В другом исследовании было показано, что вирусный белок ACE2 демонстрирует сильное иммуноокрашивание в островках поджелудочной железы, но слабое в экзокринных тканях.
Предполагается, что вирус SARS-CoV-2 серьезно повреждает островковые клетки поджелудочной железы и способствует развитию диабета или ухудшению его течения. [9]
Колебания уровня глюкозы у больных СД и COVID-19
Неконтролируемые колебания гликемии у пациентов с сахарным диабетом при COVID-19 являются неблагоприятным прогностическим фактором и увеличивают риск развития осложнений обоих этих заболеваний.
Среди причин данного явления можно отметить [9]:
- Нерегулярное питание и снижение физической активности. К нарушению питания могут приводить и желудочно-кишечные симптомы COVID-19.
- Увеличение секреции глюкокортикоидов на фоне стресса и прием глюкокортикоидов в рамках терапии.
- Случайный или вынужденный перерыв в приеме ПССП в стационарах и выбор неоптимальной альтернативной сахароснижающей терапии.
- Прямое влияние вируса на поджелудочную железу. COVID-19 может тоже стимулировать выработку большого количества воспалительных цитокинов и привести к экстремальному стрессу у некоторых тяжелых и критических пациентов.
Принципы терапии СД при COVID-19
Согласно новейшим рекомендациям по диагностике, профилактике и лечению коронавирусной инфекции, ведение пациентов с сахарным диабетом зависит от тяжести инфекционного процесса, и в обязательном порядке требует более ответственного гликемического контроля. [9]
Легкая степень тяжести
Если температура тела больного ниже 38 °C, и при наличии кашля, слабости и боли в горле отсутствуют критерии среднетяжелого и тяжелого течения, лечение проводится в домашних условиях. Необходимости слишком сильно изменять исходный режим нет, и терапию ПССП или плановую инсулинотерапию можно продолжать.
Однако прогрессирование COVID-19 может быть быстрым, особенно на фоне гипергликемии. Поэтому больным диабетом с COVID-19, даже легкой степени, настоятельно рекомендуется увеличить частоту измерения глюкозы.
При повышении гликемии необходимо усилить терапию СД. При гликемии выше 13-15 ммоль/л нужно оценить уровень кетонов в моче и добавить генно-инженерный инсулин или аналог инсулина длительного действия.
Среднетяжелое течение
Критериями среднетяжелого течения являются:
- Лихорадка выше 38 °C
- ЧДД более 22/мин
- Одышка при физических нагрузках
- Пневмония (подтвержденная с помощью КТ легких)
- SpO2 2 баллов
Внутривенное введение короткого инсулина с помощью инфузомата следует рассматривать как терапию первой линии. Все другие сахароснижающие препараты должны быть отменены.
Целевая гликемия определяется тяжестью состояния пациента. Контроль показателей проводится каждые три часа при уровне ниже 13,0 ммоль/л и каждый час при превышении данного порога. Дважды в день необходимо также контролировать содержание кетонов в моче и лактата в крови.
Особенности лечения коронавирусной инфекции
При назначении терапии COVID-19 необходимо учитывать некоторые физиологические аспекты пациентов с сахарным диабетом, их ослабленный иммунный статус и влияние некоторых препаратов на уровень глюкозы.
- Пациенты с СД находятся в группе высокого риска присоединения бактериальной инфекции. При среднетяжелом и тяжелом течении рекомендуется вместе с этиотропной назначить и антибактериальную терапию в упредительном режиме.
- Комбинированная терапия ингибиторами протеаз ВИЧ и глюкокортикоидами обычно повышает уровень глюкозы крови. После назначения такой терапии требуется контролировать гликемию каждые 3 часа, и, в зависимости от показателей, скорость подачи инсулина может быть скорректирована.
- Из-за синергии патогенетических механизмов СД и COVID-19 пациенты находятся в группе высокого риска развития «цитокинового шторма». Рекомендуется раннее упреждающее назначение моноклональных антител для терапии «цитокинового шторма» и мониторинг клинических маркеров интерлейкинового воспаления.
- Из-за высокого риска гиперкоагуляционного синдрома обязательно назначение антикоагулянтов.
Ведение пациентов с СД и COVID-19 после выписки из стационара
На время самоизоляции требуется предусмотреть обеспечение пациентов препаратами инсулина и антикоагулянтами. Возобновление сахароснижающей терапии другими препаратами возможно после полного выздоровления.
Из-за высокой уязвимости пациентов с СД требуется максимально ограничить их посещение лечебных учреждений. Для этого стоит рекомендовать больным пользоваться услугами телеконсультаций, пролонгировать период выписки рецептов и средств самоконтроля, обеспечить доставку лекарственных средств на дом.
Роль инсулинов в лечении СД при COVID-19
Согласно всем российским и международным рекомендациям, инсулины являются препаратами выбора у пациентов с коронавирусной инфекцией.
При СД1 оптимальным режимом служит инсулиновая помпа или базис-болюсная инсулинотерапия.
При СД2 инсулины рекомендуются при любой степени тяжести: средние или длительного действия при легкой степени тяжести на фоне гипергликемии; короткого действия или базис-болюсная инсулинотерапия при средней степени тяжести; внутривенное введение инсулинов короткого действия при тяжелом состоянии. Стоит отметить, что и при глюкокортикоид-ассоциированном диабете инсулин также является препаратом первого выбора.
Современные препараты инсулинов ультракороткого сверхбыстрого, ультракороткого, короткого, среднего, длительного и сверхдлительного (инсулин деглудек) действия, а также комбинированные инсулины (ИДегАсп) позволяют подобрать оптимальный режим терапии СД на фоне COVID-19 при любых индивидуальных гликемических целях и состоянии любой степени тяжести.
Источники:
- Yang J, Zheng Y, Gou X, et al. Prevalence of comorbidities in the novel Wuhan coronavirus (COVID-19) infection: a systematic review and meta-analysis. Int J Infect Dis.2020; S1201-9712(20)30136-3. doi: 10.1016/j.ijid.2020.03.017 pmid:32173574
- Ma R.C.W. Holt R.I.G. COVID-19 and diabetes. Diabet Med. 2020;https://doi.org/10.1111/dme.14300
- W.-J. Guan, Z.-Y. Ni, Y. Hu, W.-H. Liang, C.-Q. Ou, J.-X. He, et al.Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med (2020), 10.1056/NEJMoa2002032
- The Novel Coronavirus Pneumonia Emergency Response Epidemiology Team. The Epidemiological Characteristics of an Outbreak of 2019 Novel Coronavirus Diseases (COVID-19) — China, 2020[J]. China CDC Weekly, 2020, 2(8): 113-122. doi: 10.46234/ccdcw2020.032
- Clinical characteristics of 82 cases of death from COVID-19. Zhang B, Zhou X, Qiu Y, Song Y, Feng F, et al. (2020) Clinical characteristics of 82 cases of death from COVID-19. PLOS ONE 15(7): e0235458. https://doi.org/10.1371/journal.pone.0235458
- Fadaei R, Bagheri N, Heidarian E, Nouri A, Hesari Z, Moradi N, Ahmadi A, Ahmadi R. Serumlevelsof IL-32 inpatientswithtype 2 diabetesmellitusanditsrelationshipwith TNF-α and IL-6. Cytokine. 2020 Jan;125:154832. doi: 10.1016/j.cyto.2019.154832. Epub 2019 Aug 31. PMID: 31479874.
Сахарный диабет 2 типа у пациентов, перенесших COVID-19. Обзор литературных данных
Исследование CORONADO показало, что 10,6% пациентов с сахарным диабетом, госпитализированных по поводу COVID-19, умирают в 7 дней. Несколько исследований из Нью-Йорка, Италии и Китая подтверждают, что пациенты с диабетом имеют гораздо более высокий риск смерти из-за COVID-19.
С самого начала вспышки COVID-19 много внимания было уделено выявлению факторов риска заражения инфекцией, вызванной SARSCoV-2 и тяжелых исходов заболевания, а также пониманию лежащих в их основе молекулярных механизмов.
Сахарный диабет (22%) и цереброваскулярные заболевания (22%) были определены во многих исследованиях как наиболее частые отличительные сопутствующие заболевания [1, 2, 3].
Другие ретроспективные исследования [4 – 6], показали, что наиболее частыми сопутствующими заболеваниями у людей с COVID-19, были гипертоническая болезнь (24,7%), сахарный диабет (21,2%) и ишемическая болезнь сердца (8%).
В Англии 19% людей, поступивших в реанимацию с COVID-19, страдали СД2, 1/3 из которых умерли в больнице [7]. Риск серьезных осложнений и смерти от COVID-19 у пациентов с СД2 среди населения Великобритании на 50% выше, чем у людей, не страдающих диабетом (14).
Ожирение является еще одной патологией, связанной с неблагоприятными исходами COVID-19 [8]. Причиной этого может быть ухудшение вентиляции легких в нижних отделах, с последующим снижением насыщения крови кислородом [9].
Действительно, недавний отчет Национального исследовательского центра (ICNARC) [10] в Великобритании продемонстрировал, что из 196 пациентов с ожирением (большинство из которых составляли мужчины старше 60 лет) с ИМТ >35 кг/м 2 поступили в реанимацию, большинству из них (3/4), требовалась респираторная поддержка через 2 часа после поступления. Согласно другим исследованиям, опубликованным во Франции и Великобритании, ожирение сопровождалось тяжелым течением заболевания в 15% и 41% случаев соответственно [11]. По мнению ряда авторов, основными факторами, определяющими тяжесть вирусной инфекции у пациентов с ожирением, являются гормональный дисбаланс, нарушение врожденного и адаптивного иммунитета, малоподвижный образ жизни [12, 13].
Как сахарный диабет влияет на COVID-19?
Можно выдвинуть множество патофизиологических объяснений, подтверждающих связь между СД и тяжестью COVID-19. Врожденная иммунная система, первая линия защиты от SARS-CoV-2, находится под угрозой у пациентов с неконтролируемым СД [14].
Более того, СД представляет собой состояние с высоким провоспалительным потенциалом, характеризующееся несоответствующим чрезмерным цитокиновым ответом; это было показано у пациентов с COVID-19, у которых сывороточные уровни интерлейкина-6 (IL-6), С-реактивного белка и ферритина были значительно выше, чем у пациентов без СД. Это говорит о том, что люди с СД2 более подвержены развитию цитокинового шторма, который в итоге приводит к ОРДС и полиорганной недостаточности. Кроме того, вышеупомянутое исследование также показало, что пациенты с COVID-19 и СД имели более высокие уровни D-димера, чем пациенты без СД [15]; что характеризуется чрезмерной активацией системы гемостаза.
Сахарный диабет связан со сниженной экспрессией ангиотензин-превращающего фермента 2 (АПФ2), который широко экспрессируется в легких (особенно пневмоцитах II типа), почках, кишечнике и эндотелии сосудов.
В нормальных физиологических условиях АПФ2 разлагает ангиотензин-II и в небольшой степени ангиотензин-I до более мелких пептидов, а именно ангиотензина (1-7) и ангиотензина (1-9) соответственно. Легочная система АПФ2 / Ang (1-7) играет мощную противовоспалительную и антиоксидантную роль.
Соответственно, низкая экспрессия АПФ2 при СД может объяснять повышенную частоту тяжелых повреждений легких и ОРДС при COVID-19 [16,17].
Недавнее исследование (в настоящее время находящееся на стадии предпечатной подготовки) показало, что неструктурные белки SARS-CoV-2 атакуют β1-цепь гемоглобина, приводя к диссоциации железа от порфирина, тем самым нарушая способность гемоглобина переносить кислород [18]. Хотя это всего лишь гипотеза, SARS-CoV-2 может иметь более высокое сродство к связыванию с гликированным гемоглобином, чем с негликированным.
Как COVID-19 влияет на основной сахарный диабет?
COVID-19 может привести к ухудшению инсулинорезистентности у людей с СД2 и СД1 (особенно у тех, кто страдает ожирением и имеет инсулинорезистентность, помимо абсолютного дефицита инсулина).
Даже среднетяжелое течение COVID-19 может вызывать провоспалительную активность, о чем свидетельствуют высокие уровни IL-6, IL-1β, фактора некроза опухоли α (TNFα), хемоаттрактантного белка моноцитов-1 (MCP-1) и индуцибельного белка-10, что в дальнейшем может приводить к снижению чувствительности к инсулину.
Более того, ожирение, обычно связанное с СД2, может сильнее стимулировать цитокиновый ответ, тем самым еще больше усугубляя инсулинорезистентность [19].
Наконец, COVID-19 часто связан с гипокалиемией; это было связано с подавлением легочного АПФ2, уменьшением деградации ангиотензии-II и последующим повышением секреции альдостерона [20]. Гипокалиемия, в свою очередь, может ухудшить контроль глюкозы у пациентов с СД1 и СД2 [21].
В условиях преобладающих общенациональных запретов ограничение передвижения на открытом воздухе ограничит воздействие солнечного света, ведущее к дефициту витамина D[22].
Гиповитаминоз D долгое время считался фактором риска инсулинорезистентности, следовательно добавление витамина D улучшает чувствительность к инсулину [23].
Таким образом, дефицит витамина D может привести к ухудшению гликемического профиля у пациентов, впоследствии инфицированных COVID-19.
Также необходимо учитывать роль лекарств, используемых в лечении COVID-19. Кортикостероиды, применяемые у пациентов с сопутствующим ОРДС, могут приводить к повышению уровня глюкозы крови. Лопинавир-ритонавир вызывает липодистрофию с последующей инсулинорезистентностью [24].
Интерфероны 1 типа (интерферон-β1) также исследовались в качестве потенциального средства лечения COVID-19 [25], и терапия данным препаратом была связана с повреждением β-клеток [26].
Азитромицин также использовался в сочетании с гидроксихлорохином при COVID-19 [27]; макролидный антибиотик может повышать риск гипергликемии у людей с сахарным диабетом [28].
Помимо обострения гипергликемии, ретроспективное исследование из Ухани показало, что около 10% пациентов с СД2 и COVID-19 перенесли по крайней мере один эпизод гипогликемии (
Сахарный диабет и COVID-19: уроки пандемии и рекомендации врачей. Часть 2
Фото носит иллюстративный характер. Из открытых источников. 07.05.2021 Татьяна Мохорт, заведующая кафедрой эндокринологии БГМУ, доктор мед, наук, профессор; Наталия Карлович, главный врач Республиканского центра медреабилитации и бальнеолечения, главный внештатный эндокринолог Минздрава, кандидат мед. наук и др. соавторы.
(Продолжение. Начало материала смотрите здесь).
Впервые выявленная гипергликемия
Выбор терапии определяется степенью гипергликемии и тяжестью общего состояния пациента:
- при гликемии менее 10 ммоль/л, среднетяжелой форме инфекции COVID-19, отсутствии противопоказаний можно инициировать лечение препаратами сульфонилмочевины (гликлазид до 120 мг в сутки);
- при гликемии 10–13 ммоль/л в течение суток, отсутствии кетонов в моче инициировать лечение ИПД, начальная доза 0,15 ЕД/кг массы тела подкожно в 22 часа (дозу титровать в соответствии с изложенными ранее принципами);
- при двукратном выявлении гликемии более 13,0 ммоль/л, в т. ч. если ранее инсулин не назначался, инициировать инсулинотерапию ИКД, определить кетоны в моче. Дозу титровать в соответствии с изложенными ранее принципами.
Гипергликемия у пациентов с СД 2-го типа без использования инсулинотерапии:
- при развитии среднетяжелой или тяжелой формы клинического течения COVID-19 отменить препараты метформина, ингибиторы натрий-глюкозного котранспортера 2-го типа (эмпаглифлозин);
- метформин может повышать уровень молочной кислоты с развитием лактатацидоза (несмотря на доказанность пользы использования метформина на этапе до развития или легкой формы COVID-19);
- ингибиторы натрий-глюкозного котранспортера 2-го типа повышают диурез, вызывают изменение водного баланса и гиповолемию, увеличивают риск развития кетоацидоза;
- при среднетяжелой форме клинического течения COVID-19 и достижении целевых значений гликемии продолжать лечение производными сульфонилмочевины (гликлазид, глибенкламид, гликвидон), ингибиторами дипептидилпептидазы-4 (ситаглиптин, вилдаглиптин, линаглиптин), агонистами рецептора глюкагоноподобного пептида-1 (лираглутид);
- при развитии тяжелой формы клинического течения COVID-19 отменить производные сульфонилмочевины (гликлазид, глибенкламид, гликвидон), ингибиторы дипептидилпептидазы-4 (ситаглиптин, вилдаглиптин, линаглиптин), агонисты рецептора глюкагоноподобного пептида-1 (лираглутид). Для коррекции гипергликемии показана инсулинотерапия;
- инициировать лечение ИПД при недостижении целевых значений гликемии на фоне лечения субмаксимальными/максимальными терапевтическими дозами сахароснижающих препаратов. Возможна комбинированная схема инсулинотерапии: сахароснижающие ЛС и ИПД. Начальная доза ИПД 0,15 ЕД/кг массы тела в 22 часа;
- рассмотреть инициацию инсулинотерапии ИКД при двукратном выявлении гликемии более 13,0 ммоль/л, определить кетоны, отменить производные сульфонилмочевины.
При гипергликемии у пациентов с СД, получающих инсулинотерапию:
- инициировать инсулинотерапию ИКД при двукратном выявлении гликемии более 13,0 ммоль/л, определить кетоны в моче;
- увеличить дозу ИПД и ИКД на 10–15 % равномерно во всех инъекциях (чаще 1–2 ЕД в каждой инъекции) под контролем гликемии (возможно проведение экспресс-анализа с использованием глюкометра), целевые значения гликемии см. в табл. 3;
- титровать дозу ИКД в соответствии с примерным алгоритмом (см. табл. 4); дозу ИКД и ИПД распределяют 50/50 %;
- при помповой ИТ временный базальный уровень инсулина увеличивается от 20 % до 100 % и может использоваться до начала нормализации уровня глюкозы крови и исчезновения кетонов крови или мочи на основании мониторинга глюкозы, кетонов.
При развитии кетоацидоза необходима консультация врача-эндокринолога (врача-реаниматолога).
Лабораторные критерии диабетического кетоацидоза: уровень гликемии >13,0 ммоль/л; рН